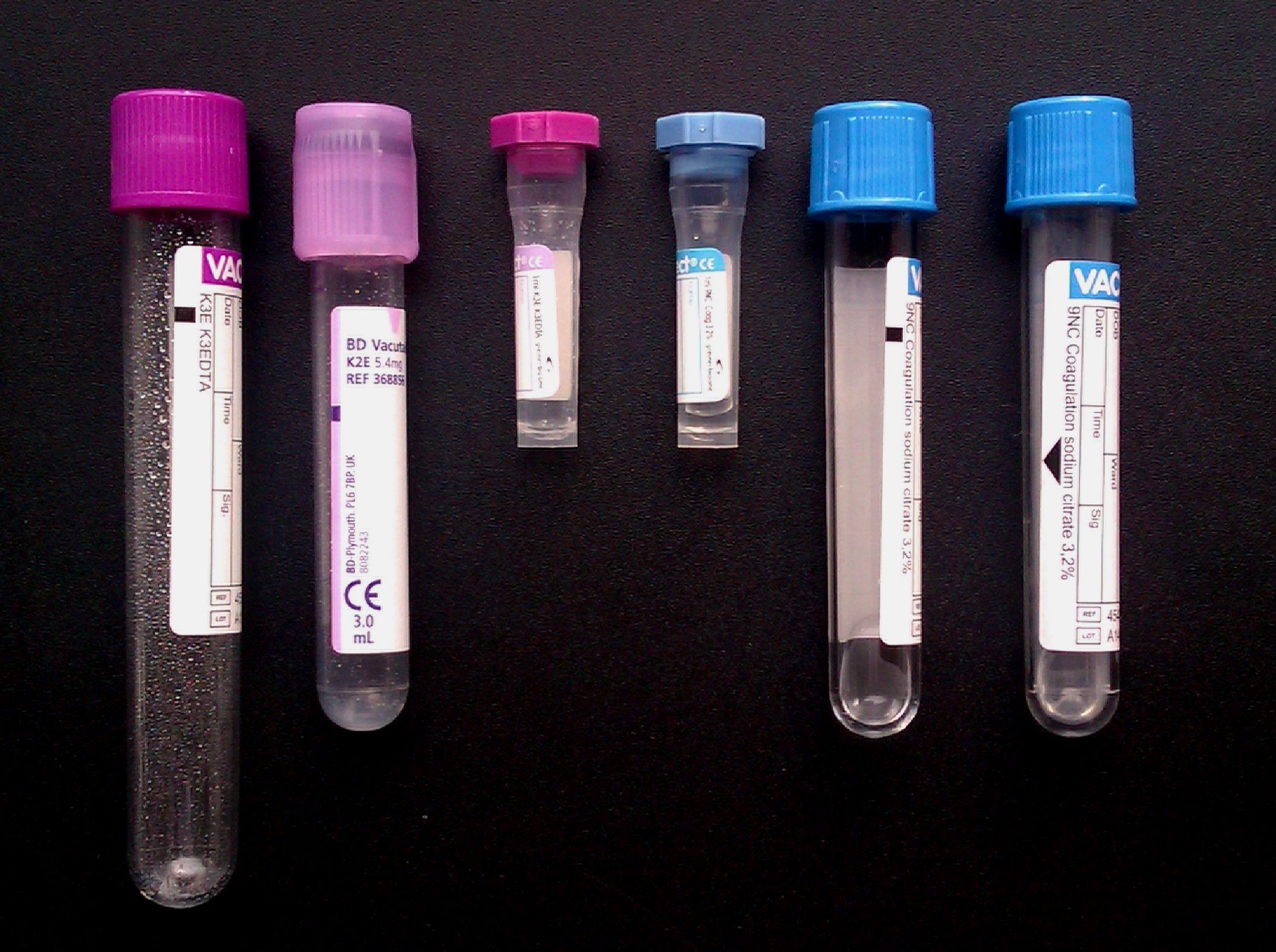
Resim 1. Kan sayımı ve çevre kanı yayması için kullanılan mor kapaklı EDTA’lı tüpler (10 mL, 3 mL ve 1 mL), pıhtılaşma testlerinde kullanılan çeşitli büyüklükteki (1 mL, 5 mL ve 3 mL) mavi kapaklı sitratlı tüpler.
Hematoloji laboratuvarında kan sayımı ve çevre kanı yaymaları için EDTA’lı, koagülasyon (pıhtılaşma) testlerinde ve pıhtılaşma faktörleri ölçümünde sodyum sitratlı (kısaca sitratlı) tüpler kullanılır. Tüplerdeki antikoagülanların (EDTA, sitrat) görevi kandaki kalsiyumu bağlıyarak kanın pıhtılaşmasını önlemektir. Pıhtılaşma testlerinde antikoagülanın miktarı çok önemlidir ve bunun için % 3,2’lik sodyum sitratlı tüpler kullanılır. EDTA’lı plazmanın pıhtılaşma testlerinde kullanılmamasının nedeni, EDTA’nın pıhtılaşma testi sırasında gerekli olan kalsiyumu da bağlıyacak kadar güçlü bir kelatör olmasıdır. Antikoagülanlı tüplere kan alarak laboratuvara göndermek test yapılmadan önceki ilk önemli adımdır. Bu yazıda genel olarak kan sayımı ve pıhtılaşma testlerinin analiz öncesi evresi (preanalitik evre) hakkında bilgi verilecektir.
Analiz Öncesi Etmenler
Laboratuvar sonuçları hastalara tanı konulmasında, tedavilerinde ve daha sonra yapılacak ayrıntılı tetkiklerde doğrudan etkilidir.
Laboratuvarlarada iç ve dış kalite programı uygulamaları sonuçların doğru, güvenilir ve tekrarlanabilir olduğunu güvence altına alır. Laboratuvar cihazlarındaki teknolojik gelişmeler ve kalite kontrolü programları sayesinde analiz sonuçlarının doğruluk derecesi artmıştır. Ancak bu gelişmelere karşın analiz öncesindeki değişkenlerin, test sonuçlarında etkili temel unsur olduğu görülmüştür. Analiz için gönderilen örnekler uygun şekilde alınmamış ve gönderilmemişse, laboratuvarda analiz ne kadar doğru yapılsa da, sonuçlar anlamsız ve yanlış olacaktır. Bunun hastaya yansıması da olumsuz olacaktır. Bu durumda yapılması gereken; hangi etmenlerin analizleri etkileyeceğini bilerek ve bunları göz önünde bulundurmak ve gerekli önlemleri almaktır.
Başlıca Analiz Öncesi Değişkenler
Analiz öncesi değişkenler; kan örneğinin alınması, örneklerin hazırlanması ve hasta ile ilgili etmenler olmak üzere 3’e ayrılabilir.
| Aşama ve Faktörler | Etmenler |
| Örnek alınması |
|
| Örnek işlemleri |
|
| Hasta ile ilgili etmenler |
|
Örnek alınması
- Hastanın kimliğinin saptanması ve örneklerin etiketlenmesi : En önemli analiz öncesi hata kan alırken kimlik saptanmasında veya tüplerin yanlış etiketlenmesidir. Hastanın bilincinin yerinde olmaması, kimlik bilgileri yazılı kol bantlarının bulunmaması veya dikkat edilmemesi bu hataya yol açar. Aynı isimdeki hastalar da karışıklığa neden olabilir. Önce kanların alınması ve daha sonra tüplerin etiketlenmesi de hatalara neden olur.
Kimlik hatasını önlemek için kola takılı kimlik bantları hasta başında elektronik olarak okutularak örnek tüplerine barkod etiketi basılan uygulamalar yapılmaktadır. Ancak bu ayaktan gelen hastalar için uygun değildir, bu durumda önceden hasta barkodu yapıştırılmış tüplere kimlik doğrulanarak kan alınır.
- Kan alma tekniği: Kanın alınması sırasında da hata yapılabilir. Turnikenin aşırı sıkılması veya damara girerken zorlanılması dokulardaki tromboplastini açığa çıkarır. Doku tromboplastini pıhtılaşma testleri sonuçlarının olduğundan daha kısa bulunmasına neden olur. Turnike bir dakikadan fazla sıkılmamalı ve damara tek denemede girilmelidir. Daha iyi ve çabuk serum ayırmak için kulanılan jelli tüplerde pıhtılaşma aktivatörü bulunmaktadır. Kapalı sistemle kan alınırken önce aktivatörlü tüp kullanılırsa, aktivatör iğneden sitratlı tübe bulaşır. Aynı şekilde kuvvetli antikoagülan etkiye sahip EDTA ve florürlü tüplerde de buna dikkat edilmelidir. Bunları önlemek için kan alınırken kullanılması tavsiye edilen tüp sırası aşağıdaki gibi olmalıdır.
- Kan kültürü şişeleri (bakterilerin üremesi için sıvı besiyeri içerir).
- Hiçbir madde içermeyen katkısız tüpler.
- Pıhtılaşma testleri için sodyum sitratlı (mavi kapaklı) tüpler.
- Aktivatörlü serum ayırma tüpleri.
- Jelli serum ayırma tüpleri.
- Heparinli (koyu yeşil kapaklı) tüpler.
- EDTA’lı (mor kapaklı) tüpler.
- Asit-sitrat-dekstrozlu tüpler (ACD).
- Florürlü (gri kapaklı) glukoz ölçümü için kullanılan tüpler.
| Kan Alması Sırasında Yapılan Hatalar |
|
- Örnek miktarı: Pıhtılaşma testi için kullanılan (mavi kapaklı) tüplerde kan/sitrat oranı çok önemlidir. Vakumlu örnek tüpleri (mavi kapaklı) bir kısım antikoagülan (% 3,2’lik sodyum sitrat) dokuz kısım kan alacak şekilde ayarlanmıştır. Çocuklarda küçük tüpler (1 mL), yetişkinler için ise daha büyük tüpler (3 – 5 mL) kullanılır. Sitratlı tüplerde nereye kadar kan konulması gerektiği işaretlidir. İşaretli seviyenin en az %90’nına kadar kan doldurulmuş olmalıdır. Eksik kan olan tüplerde, sitrat miktarı fazla olduğundan pıhtılaşma zamanı uzun çıkacaktır. Aynı şekilde çok kan konması da testin sonucunu olumsuz etkiler. Bu durumda yeniden kan alınmalıdır.
Hematokriti (HTC) yüksek olan (>%55) hastalarda kan/sitrat oranını ayarlamak gerekir. Bunun için “Sitrat miktarı (mL)= (1,85x 10-3 x (100-HTC))x V (mL)” formülü ile hesaplanır. Formüldeki “V” tübün içine konacak sitrat ve kanın toplam hacmidir.
Örneğin hematokriti %67 olan hastadan 5 mL’lik tübe kan alınacaksa “Sitrat miktarı =1,85×10-3 x (100-67)x 5, sonuç=0,305 mL” dir. Kısaca tüpte 0,305 mL sitrat olmalıdır, üzerine de 4,695 mL kan konmalıdır.
Kan alındıktan sonra tüp 6 defa aşağı yukarı hafifçe çevrilerek (köpürtülmeden) sitratın kanla karışması sağlanır. Tübün üzerine hasta bilgileri eksiksiz yazılır. Hasta antikoagülan tedavisi görüyorsa istek kağıdında bu bilgiler belirtilmiş olmalıdır.
Heparin tedavisi gören hastalardan tedavinin uygulandığı koldan örnek alınmaz. Kan diğer koldan alınmalıdır.
Kateterden kan almak zorunda kalındığında önce kateterdeki heparin 5 mL serum fizyolojikle yıkanır. Ardından atılmak üzere 5 mL kadar kan bir tübe alınır ve bundan sonra sitratlı tüp kullanılır.
- Tüplerin son kullanma tarihleri: Tüpler bekledikçe içlerindeki antikoagülanın etkinliği azaldığından son kullanma tarihine dikkat edilmelidir.
Örnek işlemleri
Örneklerin alınması kadar laboratuvara gönderilmesi, santrifüj edilmesi ve saklanması da çok önemlidir.
- Bekletme, santrifüj ve saklama: Aşırı sıcak örneklerin bozulmasına neden olur. Radyatör yanında veya arabanın ön camında güneşte bekletilen EDTA’lı örneklerde plazma proteinleri denatüre olarak, kan sayımı cihazlarında trombosit sayısının yüksek bulunmasına neden olur. Eritrositler de sıcakta bozulurlar (Resim 2).
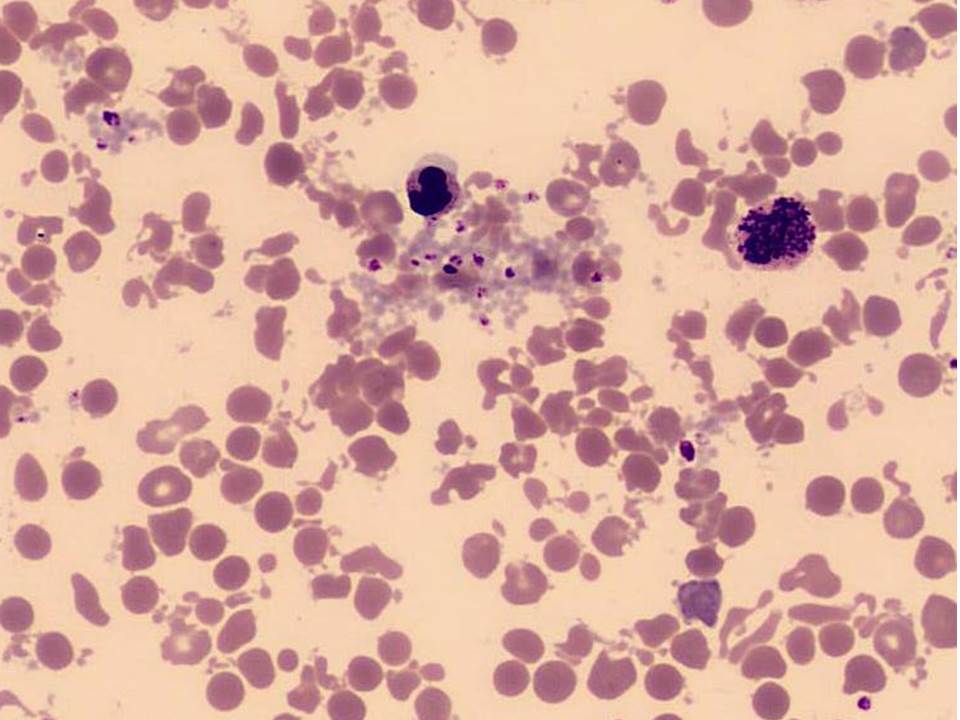
Resim 2. Yanlışlıkla sıcakta bekletilmiş EDTA’lı kandan hazırlanmış çevre kanı yayması (MGG). Lökosit ve eritrositler deforme olmuş ve açık gri renkte boyanmış protein çökeltileri görülmektedir.
Son çalışmalarda 6 saatten uzun süre oda ısısında beklemiş plazmalarda protrombin zamanı ve INR’nin %10’dan fazla değişikliğe uğradığı gösterilmiştir.
Rutin pıhtılaşma testleri (PZ, aPTZ ve pıhtılaşma faktörü aktiviteleri) için sitratlı tüpleri 1500 g’de 10-15 dakika santrifüj etmek yeterlidir. Daha yüksek devirde santrifüj trombositlerin aktive olmasına neden olur, bunun sonucunda da ortaya çıkan fosfolipidler lupus antikoagülanına (LA) bağlanır ve LA testi yalancı olarak negatif bulunabilir. Dondurup çözmek de trombositlerdeki fosfolipidlerin plazmaya geçmesine ve lupus antikoagülanının maskelenmesine neden olabilir. Önlem olarak LA testi için saklanacak plazmalar ikinci defa santrifüj edildikten sonra dondurulur. Nakledilirken uzun süre titreşime uğrayan örneklerde trombositlerin aktive olacağı unutulmamalıdır. Bu özellikle trombosit fonksiyonuna bakılırken önemlidir.
İdeal olarak pıhtılaşma testleri bir saat içinde santrifüj edilerek dört saat içinde de testler yapılmalıdır. Daha uzun süre bekleyecek plazmalar dondurularak saklanmalıdır.
4oC’de 24 saatten uzun süre saklanan plazmalarda, FVII’nin soğukta aktivasyonuna bağlı olarak INR kısalır.
Örneklerin dondurucuda saklanma sıcaklığı da raf ömrünü etkiler. Örnegin -35°C’da dondurulan plazmalar birkaç yıl saklanabilirken -20°C yeterli değildir. Arka arkaya dondurup çözmek pıhtılaşma faktörünün aktivitesinin düşmesine neden olur. Örneğin FXII ve vWF aktivitesi düşer.
Hasta ile ilgili faktörler
Yaş, cinsiyet, gebelik gibi fizyolojik faktörler ve bazı hastalarda görülen patolojik durumlar (HCT > %55, kriyoglobulinemi, soğuk aglutinin hastalığı, Lupus antikoagülanı, EDTA’ya bağımlı aglutininler) testler etkilenir. Bunların etkileri test sırasında fark edilemeyebilir ancak bilinmeleriyle yanlışlıklar önlenebilir. Örneğin, referans değerleri düzeltilir, soğuk aglutinin için örnek 37°C’da alınır veya psödotrombositopenide olduğu gibi farklı bir antikoagülan (sitrat) kullanılır.
Hirudin ve trombin inhibitörü kullanan hastalarda pıhtılaşma faktörlerinin aktiviteleri düşük ölçülür. Lupus antikoagülanı da pıhtılaşma faktörü aktivitelerinin düşük bulunmasına neden olur. Kan alınırken zorlanma, kısmi pıhtılaşma faktörü aktivasyonuna neden olacağından test sonuçlarının olduğundan daha kısa çıkmasına yol açar.
- Yaş: Yeni doğanlarda K vitaminine bağımlı pıhtılaşma faktörleri düşüktür. Ancak altı ay sonra erişkin değerine ulaşır.
- Fizyolojik Değişiklikler: Örneğin gebelikte F VIII, vWF, fibrinojen yüksek, protein S miktarı düşüktür. Yine gebelerde trombosit sayısında da düşüş görülebilir (gebeliğin fizyolojik trombositopenisi).
- Kriyoglobulinler: Kanın oda ısısında bekletilmesi sırasında çöken kriyoglobulinler trombosit ve lökosit sayısının yüksek bulunmasına neden olur.
- EDTA’da trombositlerin kümeleşmesi: Trombositlerin yüzeyindeki glikoproteinlere, EDTA varlığında bağlanarak, etkinleşen oto-antikorlar, trombosit sayısının düşük çıkmasına neden olurlar (psödotrombositopeni). Trombosit sayısını kontrol için hazırlanan yaymalarda trombosit kümeleri aranmalı veya sitratlı örneklerde trombosit sayımı tekrarlanmalıdır. Sitratlı kan ile yapılan sayımda 1/9 oranında sulandırma hesaba katılmalıdır. Pratik olarak sitratlı kan sayımı sonucu 1.1 ile çarpılarak gerekli düzeltme yapılır.
Analiz Öncesi Hataları Önlemek için Yapılması gerekenler
Laboratuvarda takip edilen kalite kontrolü programlarıyla analiz öncesi hataları önlenemez. Bunun için analiz öncesi el kitapçıkları hazırlanarak gerekli önlemler alınmalıdır. Çok sayıda test istenen yatan hastalardan alınan örnek miktarları en az düzeyde tutularak, kan kaybına bağlı bir aneminin oluşması önlenmelidir. Örnekler alındıktan sonra yapılacak tüm işlemler açıkça yazılmış olmalıdır. Her laboratuvarın kalite el kitabında güncel analiz öncesi standartları bulunmalıdır.
Kaynaklar:
- www.practical-haemostasis.com
- Kottke-Marchant K, Davis B H : Laboratory Hematology Practice, Wiley-Blackwell, 2012.
- WHO guidelines on drawing blood: best practices in phlebotomy.
- Fairweather et al. Monitoring of Anticoagulant Therapy. Arch Pathol Lab Med 1998; 122: 768-781.
- Türk Hematoloji Derneği. Hematoloji Laboratuvarı Kılavuzu-1, 2014
- Zehnder JL. Clinical use of coagulation tests, www.uptodate.com, 2014.
- Favaloro et al. Pre-analytic Variables in Coagulation Testing Associated With Diagnostic Errors in Hemostasis, Lab Med 2012; 43(2) : 1-10