Yaymaların hazırlanması
Enjektördeki ilik örneği bir lam üzerine ya da bir Petri kabına boşaltılır. Normal bir ilikte çevre kanı (ÇK) içinde Anglosaksonların “spikül” ya da “partikül” adını verdiği açık renkte küçük tanecikler (kırıntılar) dikkati çeker. Bunlar aspirasyon örneğinin kemik ve yağdan oluşmuş ilik hücrelerinden zengin bölümleridir. Aslında ÇK ile seyrelmiş kısımlar değil, bu kırıntıların yayılması gerekir. Bunun için lama konan örneğin kanı lam hafifçe eğilerek akıtılır ya da Petri kutusundaki kan emici kağıt veya Pasteur pipeti yardımı ile uzaklaştırılır. Kanlı kısımdan yaymalar yaptığınız takdirde preparatınız ilik hücrelerinden fakirleşmiş olacaktır. Aspirasyon sırasında Kİ’nin ÇK ile aşırı seyrelmesini önlemek için enjektöre 0.5 ml’den fazla örnek çekilmemelidir.
- Yayma yöntemleri: 1. Aspirasyon örneğinde taneciklerin ÇK gibi yayılması. 2. Aspirasyon örneğinde tanecikleri ezme (İng crush) yöntemi. 3. Biyopsi örneğini lama hafifçe dokundurma yöntemi (İng. touch imprint). Tanecikler toplanarak pıhtılaştırıldıktan sonra kesit yapılması ya da EDTA ile karıştırıldıktan sonra santrifüjle ilik hücrelerinden zengin tabakanın (buffy coat) elde edilmesi yöntemleri sanırım ülkemizde pek kullanılmamaktadır .
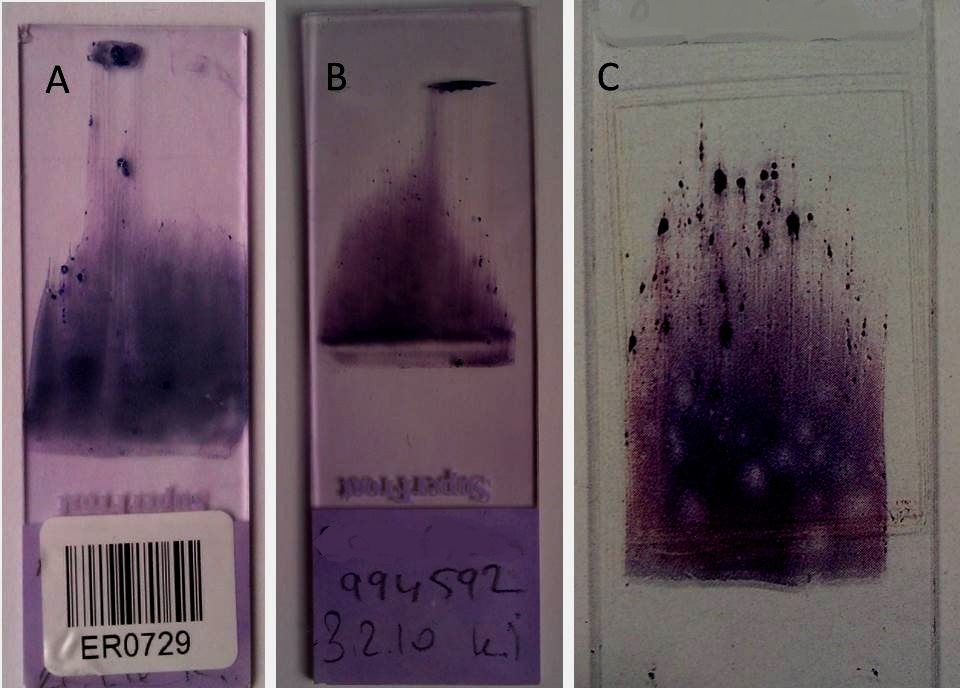
- İliğin doğrudan lama yayılması. ÇK yaymalarının yapılmasında gözetilen ilkelerden farklı değildir (ÇK yaymalarının incelenmesi). Lamlar kir, toz, yağ, parmak izinden uzak, tertemiz olmalıdır. Kimi meslektaşımızın bu ilkeyi göz ardı ettiğini biliyoruz. Lamla ya da lamelle yayılmış yaymalar bekletilmeden havada kurutulmalıdır. Gençliğimizde ellerimizle havada sallayarak kuruturduk (!). Bu amaç için minik bir vantilatör (bir meslektaşımızın ABD deneyimi) ya da saç kurutma makinesi niye olmasın.Yaymalarda ilik taneciklerinin daha çok preparatın ucuna doğru, kuyruk bölümünde mum alevi (Anglosaksonlara göre tüy) biçiminde dizildikleri görülür (Resim 1).
- Ezme yöntemi. Burada kanı akıtılarak veya emilerek taneciklerden zenginleşmiş ilik lamının üstüne temiz çıplak bir ikinci lam konur, hafifçe bastırılır ve lamlar iki elin baş ve işaret parmakları arasında yatay düzeyde hızla kaydırılarak arada kalan tanecikler ezilir. Bu şekilde hücreden çok zengin, mikroskopta adeta biyopsi görünümü veren, hücre zenginliğinin (selülarite) değerlendirilebileceği yaymalar elde edilir.
- Dokundurma yöntemi. Aspirasyonla iliğin alınamadığı durumlarda (dry tap: kuru musluk), hücre morfolojisini incelemek için iğne biyopsisi ile alınan doku örneği lama hafifçe dokundurulur, sürtülür. Bu yöntemle çoğu kez hücreden zengin bir yayma sağlanamaz. Aspirasyondan kaçınarak sadece bu yolla hücre morfolojisini incelemeye çalışmak yanlıştır.
Aspirasyon yaymalarında May Grünwald-Giemsa (MGG) ile boyama dışında, sitokimyasal boyamalar (peroksidaz, esteraz, vd) ve Perls reaksiyonu ile demir boyası yapılabilir (kemik iliği yaymalarında demirin değerlendirilmesi). Gerektiğinde (demir depolarının durumu, sideroblastik anemiler) yayma potasyum ferrosiyanür ile boyanmalıdır (thalassemia ve sideroblastik anemi). Makrofajlarda demir boyasının negatif kalması demir eksikliğinin en şaşmaz kanıtıdır.
- Yaymaların mikroskopta incelenmesi
MGG ile boyanmış yaymalara önce çıplak gözle bakılır. İlik gelmişse, mutlaka tanecikler görülmelidir. Hücre zenginliği (selülarite) bu tanecikler bölgesinde incelenecektir. Büyük hücreler (megakaryositler, makrofajlar, depo hücreleri, vb), osteoblast ve osteoklast gibi kemik dokusu hücreleri de özellikle gene bu bölgede yoğunlaşmıştır.
Küçük büyültme ile inceleme
Mikroskop altında yayma önce küçük büyültme objektifi (x 10) ile taranarak hücre zenginliği, hücre tekdüzeliği (monotonluğu), miyeloid/eritroid hücre oranı (aşağıya bkz), megakaryositler, makrofajlar, diğer büyük hücreler (aşağıya bkz) ve anormal hücre toplulukları (miyelom, lenfoma, kanser hücreleri, vb) hakkında ön bilgi sahibi olunur.
- Hücre zenginliği (selülarite). Hücreselliğin yaymanın taneciklerden zengin bölgesinde araştırılması gerekir. Normal bir erişkinde kırmızı ilik/sarı ilik oranı % 40-60 arasında değişir. % 25 – 30’un altında hiposelülarite, % 60’ın üzerinde hiperselülarite söz konusudur. Örneğin aplastik anemide, MDS’nin hiposelüler tipinde ilik hücreden fakirdir. Lösemi’li, lenfoma’lı, polisitemia vera’lı ilikler hücreden çok zengindir. Hiç kuşkusuz, hücre zenginliği ezme yöntemi ile hazırlanmış preparatlarda, özellikle biyopsi örneklerinde daha doğru değerlendirilir. Yaşlılarda yağ dokusu arttığından hücre zenginliği azalır. Öyle ki, yaşla ilintili normal azalmayı gösteren bir formül bile vardır: Selülarite (%) = 100 – yaş (yıl olarak). Örn. 80 yaşında bir kişi için (100-80=20) % 20 hücresellik normal kabul edilir.
- Hücre tekdüzeliği (monotonluğu). Normal ilikte değişik olgunlukta, kırmızı (eritroid) ve beyaz (miyeloid) dizi hücreleri, megakaryositler, makrofajlar, az sayıda lenfosit, çok daha az sayıda plazma hücresi bulunur. Bu ayrışık (heterojen) tablonun aksine, tüm alanlarda tek tipte hücrelerin görülmesi akut (özellikle ALL) ve kronik (KLL, prolenfositik) lösemilere özgüdür. Bizler asistanlığımızda “silme blast” deyimini kullanırdık. Belki günümüz gençleri “komple blast” diyordur.
- Büyük hücreler. Megakaryositler iliğin normal büyük hücreleridir. Patolojik büyük hücreler arasında Hodgkin lenfoması’nın Reed-Sternberg hücreleri‘ni, dev miyelom hücrelerini (multipl miyelomda dev plazmablastlar), parvovirus B19 infeksiyonlarında görülen dev eritroblastları (jigantoblast) sayabiliriz. Büyük hücrelerden söz ederken genellikle preparatın kuyruk kısmında toplanmış kemik dokusu kökenli osteoblast ve osteoklastları da unutmamak gerekir (Kİ’nin diğer hücreleri). Osteoblastlar miyelom hücreleri, çok çekirdekli osteoklastlar ise megakaryositlerle karıştırılmamalıdır.
- Yabancı hücre toplulukları. Sıklıkla yaymanın kenarlarında ve kuyruk kısmında toplanmış yabancı hücre kümeleri öncelikle kanser metastazlarını akla getirmelidir. Kümeyi oluşturan hücrelerin sınırlarının belirginsizliği karakteristiktir. Bazen tümör hücreleri rozet biçiminde topluluklar yaparlar (nöroblastoma hücreleri). Normal osteoblastların da kümeler meydana getirebilecekleri unutulmamalıdır.
- Aspirasyonla Kİ örneğinin alınamaması. Ponksiyon iğnesinin ilik boşluğuna girmiş olduğuna emin olunduğu halde örnek alınamaması durumunda (kuru musluk) şu olasılıklar düşünülmelidir. 1) İlik hücreden çok fakirdir (örn. aplastik anemi). 2) Yaygın fibroz vardır (primer miyelofibroz, tüylü hücreli lösemi). 3) İlik hücreden son derece zengindir (yaygın lösemi, lenfoma infiltrasyonlarında hücrelerin birbirleriyle kenetlenmesi ). Bu tür durumlarda Kİ biyopsisi yapılmalı ve morfolojik inceleme için alınan doku örneğinden lama dokundurma yaymaları hazırlanmalıdır.
- Kİ nekrozu ve jelatinimsi dejenerasyon. Çok seyrek de olsa aspirasyonla nekrozlu bir ilik örneği elde edilebilir. Eozinofilik boyanmış şekilsiz bir zemin üzerinde sınırları belirsiz hücre artıkları ve ezilmiş çekirdekler dikkati çeker. Nedenler arasında hematolojik ya da hematoloji dışı tümör hücreleri ile iliğin tutulması, Kİ infarktüsü (örn. orak hücre hastalığında damar tıkayıcı krizler), kemiğin aseptik nekrozu, kemik ışınlamaları ve infeksiyon sayılabilir. Hastalar genellikle ateş ve kemik ağrılarından yakınır. ÇK’da sitopeniler, LDH ve alkali fosfatazda yükselme sıktır. Anorexia nervosa’lı hastalarda görülen iliğin jelatinimsi dejeneresansı sitopeniler ve yağ dokusunda atrofi ile kendini gösterir. Gerek nekroz, gerek jelatinimsi dejeneresans tanısı için seçilecek doğru yöntem ilik biyopsisidir.
Büyük büyültme ile inceleme
- Beyaz ve kırmızı dizi hücreleri. Büyük büyültme objektifleri ile (x 40, x 100 immersiyon objektifi) ile gençten olguna doğru beyaz dizi (miyeloblast, promiyelosit, miyelosit, metamiyelosit, çomak, parçalı) (miyeloid dizi), ve kırmızı dizi (proeritroblast, bazofil eritroblast, polikromatofil ve ortokromatofil eritroblast) (eritrosit yapımı) gözden geçirilerek olgunlaşmada bir duraklama olup olmadığı araştırılır. Her iki dizide de normalde gençten en olguna doğru kesintisiz bir olgunlaşma görülür. Ayrıca her iki dizi hücre displazisi yönünden dikkatle incelenmelidir (MDS?) (miyelodisplastik sendrom).
- Miyeloid/eritroid hücre oranı (M/E ratio): Normalde M/E oranı 2:1 ile 4:1 arasında değişir. Örneğin bu oran KML’de ve salt kırmızı dizi aplazisinde artmış, akut /kronik hemolitik anemilerde ve ilâçlara bağlı agranülositozda azalmış bulunur.
- Eritropoez normoblastik ya da megaloblastik karakterde olabilir. Megaloblastik eritropoezde hücreler daha büyük, çekirdek kromatini çok daha ince olduğu gibi, çekirdek olgunlaşması ile sitoplazma olgunlaşması arasındaki eş zamanlılık çekirdek aleyhine bozulmuştur. Beyaz dizide dev metamiyelosit ve çomaklar, nötrofil parçalılarda hipersegmentasyon dikkati çeker (megaloblastik eritropoez).
- Megakaryositler sayı, büyüklük ve morfoloji açılarından ele alınır (trombosit yapımı). Çevrelerinde protrombosit uzantıları ya da olgun trombositler aranır. Örn. İTP’de megakaryositlerin çevresi çoğu kez trombositsizdir. Çekirdekler normalde olduğu gibi poliploid görünümde midir? Yoksa değişik çekirdek anomalileri mi söz konusudur? Örn. tek çekirdekli küçük hücre (mikromegakaryosit) (MDS), birden fazla çekirdek (MDS) (miyelodisplastik sendrom), çekirdekte loblaşmalar, geyik boynuzunu andıran dallı budaklı çekirdekler (esansiyel trombositemi), megakaryositlerin içinde fagosite edilmiş gibi duran olgun ÇK hücreleri (megakaryositlerde emperipolez).
- Normal Kİ’de monositlere ve onların öncülerine (monoblast, promonosit) seyrek rastlanır (% 0-3) (monositler). Buna karşılık monositlerden türeyen çeşitli işlevlere sahip makrofajlar (eski adları ile histiyositler) normal KI’nin büyük hücreleri arasında yer alır (20-30 µm). Rengi açık mavi-griden soluğa kadar değişen sitoplazmada fagosite edilmiş hücreler, apoptoza uğramış hücre artıkları, vaküoller görülebilir. Ortalarında makrofajın yer aldığı eritroid hücre adacıklarına rastlanabilir (sütnine makrofajlar). Retiküler hücreler (eskiden retikulum hücresi denirdi) iliğin çatısını yapan stroma hücreleridir. Retikülin lifleri bu hücreler tarafından yapılır (kemik iliğinin diğer hücreleri).
- Patolojik durumlarda çok sayıda değişik morfolojide makrofaj (histiyosit) görülebilir: lipid depo hastalıkları (Gaucher, Niemann-Pick), eritrosit, trombosit ya da nötrofilleri yutmuş hemofagositik sendrom hücreleri (hemofagositik lenfohistiositoz, hemofagositik sendrom), deniz mavisi (sea-blue) histiyositler gibi (kemik iliğinin diğer hücreleri). Bazı infeksiyonlarda (örn. leishmaniasis, histoplazmoz) makrofajların mikroorganizmalarla dolu olduğu saptanır kala-azar).
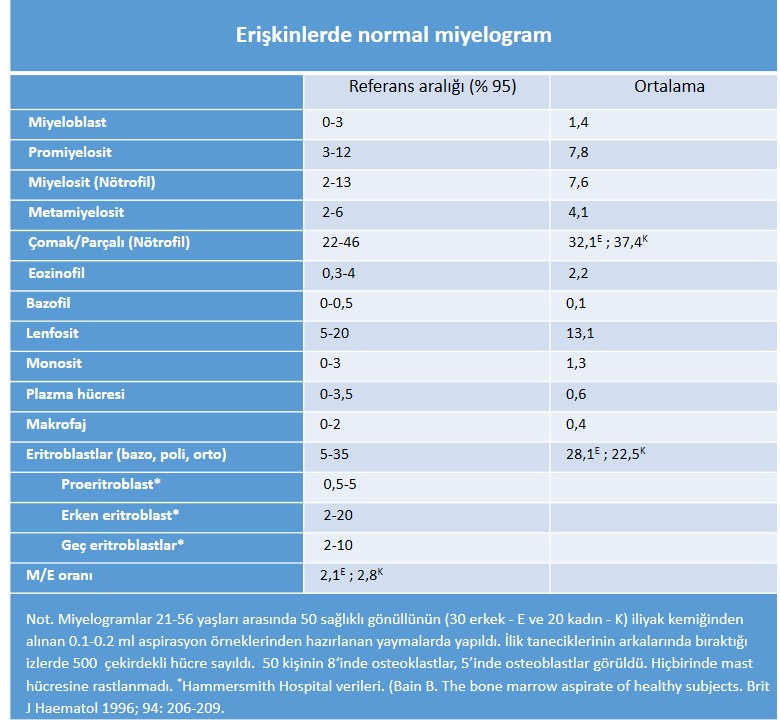
- Lenfositler (lenfositler) yenidoğanın ilk günlerinde fazla sayıda değildir. Süt çocukluğu döneminde ise Kİ’deki çekirdekli hücrelerin % 30-50’sini oluştururlar. Bu hücrelerin çekirdek/sitoplazma oranı yüksek, çekirdek kromatini olgun lenfositinkine göre daha incedir (tam olgunlaşmamış B-lenfositler). Benzer morfolojide lenfositlere daha ileri yaşta çocuklarda, hattâ erişkinlerde de rastlanabilir (hematogon). Çocuklarda yaş ilerledikçe lenfosit sayısı azalır. Erişkinlerde, aspirasyon örneği ÇK ile aşırı seyrelmemiş ise, oranları %5-20(ortalama % 13) arasında değişir (Tablo 1) .
- Plazma hücreleri (Kİ’nin diğer hücreleri) normal Kİ’de çok daha seyrek bulunur (çekirdekli hücrelerin % 0-3.5’i). Nadiren plazma hücreleri ufak topluluklar yapabilirler. Bazen 2-3 çekirdekli normal plazma hücreleri görülebilir (plazmasitozlar). Çok çekirdeklilik miyeloma özgü bir bulgu değildir.
- Aspirasyon yaymalarının incelenmesi sırasında küçük lenfositlerin (KLL, küçük lenfositik lenfoma), prolenfositlerin (kronik prolenfositik lösemi), plazmasitik lenfositlerin (Waldenström hastalığı) ve plazma hücrelerinin (multipl miyelom) sayıca artmış olup olmadıkları ve atipi gösterip göstermedikleri araştırılmalıdır. Kimi miyelom ya da lenfomada Kİ tutulumu yer yer odaklanmalar (yamalar) tarzında olabileceğinden aspirasyon yaymasında bu hücrelerde bir çoğalma saptanmayabilir. Bu gibi durumlarda aspirasyon ya da biyopsi başka bir bölgeden yenilenmelidir.
- Multipotent miyeloid hücreden türeyen mast hücreleri normal Kİ’nin ender görülen hücreleri arasında yer alır (bkz. Tablo 1 Not) (Kİ’nin diğer hücreleri). Mast hücrelerinde bazofil granüller ÇK’daki bazofil parçalıların aksine çekirdeği örtmez. Çekirdekler lobüllü değildir.
Yaymalarda çekirdekli hücre sayımı (Tablo 1). İlik taneciklerinden zengin kuyruk bölgesinde, taneciklerin izinden gidilerek 500 çekirdekli hücre sayılmalıdır. Blast ya da habis kan hücresi sayımı lösemi, lenfoma ve miyelomda tedavinin izlenmesi ve nüksler yönünden önem taşır. MDS’de alt sınıflama/prognoz açısından miyeloid dizide yapılacak blastik hücre sayımı gene aynı derecede önemlidir.
Kİ aspirasyonu raporunun hazırlanması
Raporda aşağıda sıralanan bilgilerin yer alması gerekir (7). İncelemeyi isteyen hekimin sağlayacağı hasta bilgileri ihmal edilmemeli, sonuç ve öneriler bölümü ayrıntılı olmalıdır. Bu son bölümde, önemli bulgular özetlenerek tanı belgelenmeli, tanının kesinleşemediği durumlarda ayırıcı tanı tartışılarak tanıyı sağlayacak öneriler üzerinde durulmalıdır.
| Kurumun (Laboratuvarın) adı: |
| Gönderen hekim: |
| Hasta bilgileri
Hastanın adı, soyadı: Doğum tarihi (yaş), Cinsiyet: Protokol No / Yatak No / Ev Adresi / Tlf: Kısa öykü, Klinik bulgular, Uygulanan tedavi (kemo/radyoterapi/vd): Tam kan sayımı sonuçları: Çevre kanı yayması bulguları: Ön tanı: |
| İşlemin türü (aspirasyon/biyopsi), anatomik yeri: İşlem tarihi: |
|
Hücresellik (tanecikler boyunca): Miyeloid/eritroid oran: Çekirdekli hücre formülü: Eritropoez: Miyelopoez: Megakaryositler: Lenfositler: Plazma hücreleri: Diğer hematopoetik hücreler: Blastlar, yabancı hücreler : Demir boyası: |
| Diğer incelemeler (yapılmışsa): sitokimya, sitogenetik, PCR, FISH, mikrobiyoloji):Akış (flow) sitometrisi (yapılmışsa): |
| Sonuç ve Öneriler: |
| Tarih, incelemeyi yapan, imza |
Yararlanılan Kaynaklar
1.Bates I. Bone marrow biopsy. in Dacie and Lewis Practical Haematology, Ninth Edition. Eds: Lewis SM, Bain BJ, Bates I. Churchill Livingstone, London. 2001: p 101-114.
2. Bain BJ, Clark DM, Lampert IA. The normal bone marrow. in Bone Marrow Pathology, Second Edition. Blackwell Science Ltd, London. 1996: p 1-50.
3. Bain BJ. The bone marrow aspirate of healthy subjects. Brit J Haematol 1996; 94: 206-9.
4. Bain BJ. Bone marrow aspiration. J Clin Pathol 2001: 54: 657-63.
5. Zehnder JL. Evaluation of bone marrow aspirate smears. www.uptodate.com, 2014.
6. Ryan DH. Examination of the marrow. in Williams Hematology, Eighth Edition. Eds.Kaushansky KS, Lichtman MA, Beutler E, Kipps TJ, Seligsohn U,Prchal JT. McGrawHill Medical, NY. 2010: p 25-37.
7. Lee SH, Erber WN, Porwit A et al. For the International Council for Standardization in Hematology. Int Jnl Lab Hem 2008; 30: 349-364.