Kan örneklerinin alınması. Yaymalar toplardamar ya da kılcal damar kanı ile yapılır. Ven kanı için antikoagülan olarak EDTA'nın (etilen diamin tetraasetik asit) potasyum tuzunu içeren eflatun kapaklı vakumlu tüpler kullanılır. EDTA kalsiyum şelasyonu yaparak pıhtılaşmayı önler. Heparin hücre morfolojilerini bozduğundan uygun değildir. Kapiler kanı parmak ucundan, bebeklerde topuk tabanının iç ya da dış kısmından alınır.
Lamların temizlenmesi. Yaymalar kirli, tozlu, yağlı lamlara yapılmamalıdır. Deterjanlarla iyi temizlenmemiş ve kurutulmamış lamlara yapılan yaymalarda çıplak gözle seçilen boşluklar oluşur. Böyle yaymalarda artefakt (yapay) olarak yer yer hedef hücreleri ya da stomatositlerle karşılaşabilirsiniz. Lamlar önceden temizlenmiş olsalar bile, yayma yapılırken tekrar silinmelerinde yarar vardır.
Yaymaların yayılması.Yayma EDTA'lı örnek 2 saatten fazla bekletilmeden yapılmalıdır. Aksi takdirde lökositlerde morfolojik değişiklikler (çekirdekte büzüşme, sitoplazmada vaküolleşme) oluşabilir.
Lamın bir ucunun 1 cm uzağına, orta çizgi üzerine kan damlası konur. Ardından yayıcı – bu bir lamel ya da lamdan daha dar, uç kısmı pürüzsüz bir cam olabilir – 30 derecelik açıyla damlanın önüne getirilir ve geriye doğru damlayla temas ettirildikten sonra elin düzgün ve hızlı hareketiyle ileriye doğru sürülür. Kan damlası sonuna kadar yayılmadan yayıcı yukarıya kaldırılmamalıdır (Resim 1). Yaymanın uç kısmı düz olmayıp ince uzun tüylü görünümdedir (Cavit Çehreli Hoca mum alevine benzetir). Kan damlasının büyüklüğüne, 30 derecelik açının azalıp çoğalmasına göre yaymanın kalınlığı değişir. İdeal bir yayma yaklaşık 3 cm uzunluğunda olmalı ve lamın diğer ucuna 1 cm kala sonlanmalıdır (Dacie & Lewis Practical Haematology).
Yaymaların boyanması. Romanowsky boyaları başlıca iki bileşene dayanır: bazik (metilen mavisi ya da azür B) ve asidik (eozin Y). Genellikle May-Grünwald-Giemsa (MGG) yöntemini kullanıyoruz. Boya metil alkol de içerdiğinden yaymaların önceden tesbiti (fiksasyon) gerekmez.
YAYMALARIN İNCELENMESİ
Yaymanın herhangi bir yerine hemen sedir yağı damlatarak mikroskopda lökosit formülü yapmaya başlamak zaman zaman hayretle izlediğimiz bağışlanması zor bir kusurdur. Yaymaya önce çıplak gözle bakılır. Uygun şekilde yayılmış, boyanmış mıdır? Kalın yayılmış ve koyu boyanmış ise işiniz zordur. Çamurdan farksızdır böyle yaymalar… Keyfinizi kaçırırlar. Eritrosit morfolojisini değerlendiremezsiniz. Lenfosit mi, blastik hücre mi ayırt edemezsiniz. En iyisi çöpe atmaktır onları… Meslek yaşamımda dışardan tanı amacıyla gönderilmiş bu tür yaymalara çoğu kez bakmamış, hastanın varsa boyanmamış yaymasını ya da EDTA'lı kan örneğini istemişimdir.
Makroskopik gözden geçirmeden sonra, yayma mikroskopta önce küçük büyültme objektifleri ile incelenmelidir. Eritrosit dağılımına bakılır. Lökositler preparata homojen dağılmışlar mıdır? Bazen yayma kusuru sonucu lökositler kümeler halinde yaymanın ince kuyruk kısmında toplanır, diğer alanlar lökositten fakir kalır. Küçük büyültme ile inceleme sırasında, normalden farklı çoğunlukta bir lökosit grubu (örn nötrofili, lenfositoz, monositoz), çekirdekli eritrositler ya da çevrede görmeye alışık olmadığımız morfolojide hücreler (örn blastlar, lenfoma hücreleri, hatta ÇK'a çıkan solid tümör hücreleri) kolaylıkla dikkatinizi çekebilir. Bu arada trombositler de unutulmamalıdır. Trombosit sayısı ve kümeleşmesi hakkında fikir edinilmelidir.
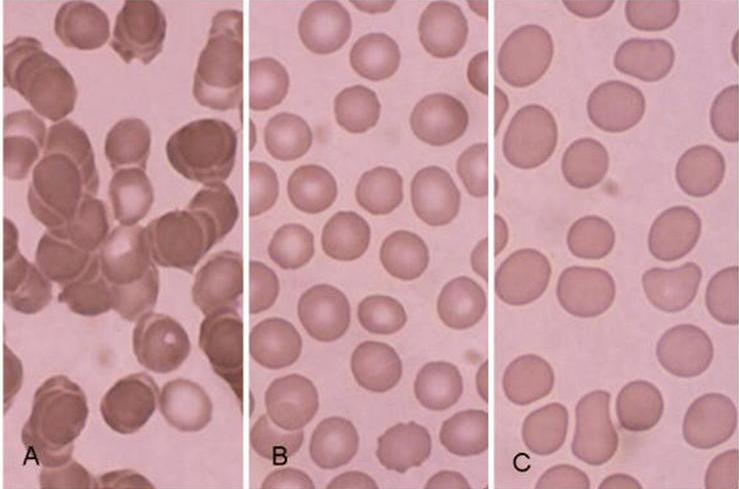
Kuşbakışı taramadan sonra eritrosit morfolojisinin inceleneceği alan seçilir (Resim 2) ve ancak şimdi sedir yağı damlatılarak immersiyon objektifinin kullanılmasına sıra gelir.
Kötü, kalın yayılmış yaymalarda bile, arandığında, eritrosit morfolojisinin incelenmesine elverişli bir yer bulunabilir. Yaymanın kalın olan “baş” kısımlarında (A) eritrositler üst üste binmiş, ince “kuyruk” kısımlarında ise yassılaşmış (C), merkezlerindeki soluk kısım kaybolmuş, çoğu kez şekilleri bozulmuştur. A ve C bölgeleri inceleme için uygun değildir. İnceleme baş ile kuyruk arasında, kuyruğa daha yakın bulunan, eritrositlerin tek tek, birbirlerine yakın durdukları alanlarda yapılmalıdır (B).
Eritrosit morfolojisi incelendikten sonra lökosit formülü yapılır. Lökopeni durumları dışında en az 200 hücre sayılmalıdır. Yaymalarda lenfosit gibi küçük hücreler daha çok ortalarda, parçalı ve monosit gibi büyük hücreler ise daha çok kenarlarda ve kuyrukta bulunurlar. Bu nedenle formül yapılırken hep kenarlarda ya da hep ortalarda dolaşılmamalı, Resim 3' de gösterildiği gibi bir yol izlenmelidir.
ERİTROSİT MORFOLOJİSİNİN İNCELENMESİ
Eritrositler boyanma (HGB içeriği ve dağılımı), büyüklük (çap), şekil, taşıdıkları inklüzyonlar, çekirdekli eritrositler, yaymaya dağılımları ve parazitler yönünden incelenir.
Boyanma değişiklikleri: Normokromi, hipokromi (merkezdeki soluk alan genişlemiştir), hiperkromi (bu terim yalnız sferositler için geçerlidir), polikromazi, anizokromi (eritrositlerin bir bölümü normokrom, bir bölümü hipokrom boyanmıştır. İki ayrı eritrosit topluluğunun bir arada olduğunu gösterir. Demir eksikliği anemisinde tedaviye yanıtın alınmaya başladığı dönemde; mikrositik ya da makrositik anemili bir hastaya eritrosit transfüzyonu yapıldığında; sferositozla giden hastalıklarda ve bazen sideroblastik anemilerde görülür. Hedef (target) hücreleri ve stomatositler'de HGB' nin hücre içindeki dağılımı değişiktir (bkz. Çevre kanında eritrosit morfolojisi).
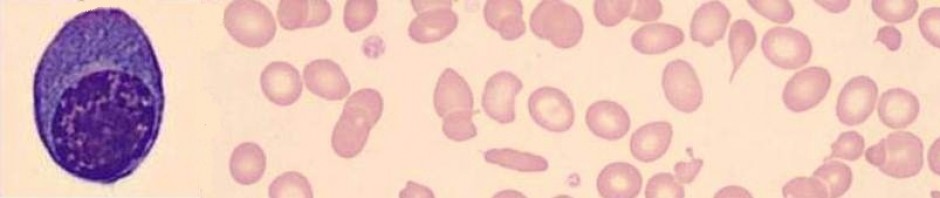
Büyüklük (hücre çapı) değişiklikleri (anizositoz): Normal eritrositler (normosit) çapları yönünden hemen hemen eşittir (7-8 mikron). Yaymalarda normal bir eritrosit dar sitoplazmalı küçük lenfosit çekirdeğine (9 mikron) yakın büyüklüktedir (Resim 4). Normalden büyük eritrositlere makrosit, küçük olanlara mikrosit denir.
Şekil değişiklikleri (poikilositoz) eritrosit yapımında bozukluk ya da dolaşan eritrositlerin dış etkenlerle zedelenmesi sonucu oluşur: sferosit, eliptosit, ovalosit, parçalanmış eritrosit, şistosit, dakriyosit (gözyaşı damlası şeklinde eritrosit)ekinosit, akantosit, orak hücre (drepanosit), kabarcık hücreleri (ısırılmış eritrosit)(bkz. Çevre kanında eritrosit morfolojisi).
İnklüzyonlar (inklüzyon cisimleri). Normalde MGG ile boyanmış yaymalarda eritrositlerin içinde herhangi bir yapı ya da oluşum yoktur. Patolojik durumlarda bazofilik noktalanma, Howell-Jolly cisimcikleri, Cabot halkası, Heinz cisimleri, siderofilik granüller (Papppenheimer cisimleri) ya da parazitler (sıtma, babeziozis) ile karşılaşılır (bkz Eritrosit inklüzyonları, Sıtma ve Kala-azar.)
Çekirdekli eritrositler. Yeni doğanda, özellikle prematürelerde, ÇK'da polikromatofil ve ortokromatofil gibi olgun eritroblastlara rastlanması olağandır. Çekirdekli eritrositler akut kanama, akut hemoliz gibi eritrosit yapımının hızlandığı durumlarda ilikten ÇK'a çıkar. Bu duruma daima retikülositoz eşlik eder. Akut lösemilerde, MDS' de, Kİ'ne yabancı bir dokunun (örn. miyelofibroz, kanser metastazı, granülom) yerleştiği miyeloftizik anemide ÇK' da çekirdekli eritrositlerle birlikte miyeloid dizinin genç öğelerine rastlanır (lökoeritroblastik reaksiyon). Lökoeritroblastozda çoğu kez retikülositoz yoktur.
Not: ÇK'da çok sayıda eritroblast bulunduğunda, otomatik sayıcılar bunları da lökosit olarak sayacağından, lökosit formülünde 100 lökosite düşen eritroblast sayısı saptanarak gerçek lökosit sayısı hesaplanmalıdır.
essay writting service
Eritrositlerin dağılımı. Rulo oluşumu (fr rouleaux: madeni para dizisi) aşırı derecede monoklonal ya da poliklonal Ig artışlarında görülür. Oto-aglütinasyon oto-immun hemolitik anemilere, özellikle “soğuk” antikorlu olanlara özgü bir bulgudur. (bkz Rulo oluşumu ve otoaglütinasyon)