Dünyadaki belli başlı kan sayımı cihazı üreticileri “Sysmex”, “Beckman Coulter”, “Abbott Cell-Dyn” ve “Siemens (Bayer) Advia”dır. Bu markalar çeşitli modellerde ve değişik özelliklerde cihazlar üretmektedir. Kan sayımı cihazlarında impedans, radyo dalgaları ve optik laser scatter (optik lazer saçılımı) olmak üzere üç temel teknoloji kullanılmaktadır.
Elektronik Kan Sayımı Yöntemleri
- İmpedans Yöntemi
Wallace Coulter (1913-1998) elektrik mühendisliğine ilgi duydu. 1950’lerde kardeşi Joe ile boş zamanlarında Chicago’daki bodrum katında mikroskopik tanecikleri (partikülleri) sayma ve büyüklüklerini ölçme konusunda çalışmaya başladılar. 1953 yılında “impedans” yöntemi ile kan hücrelerini sayma patentini aldılar ve 1958’de şirketlerini kurdular (Coulter Electronics).
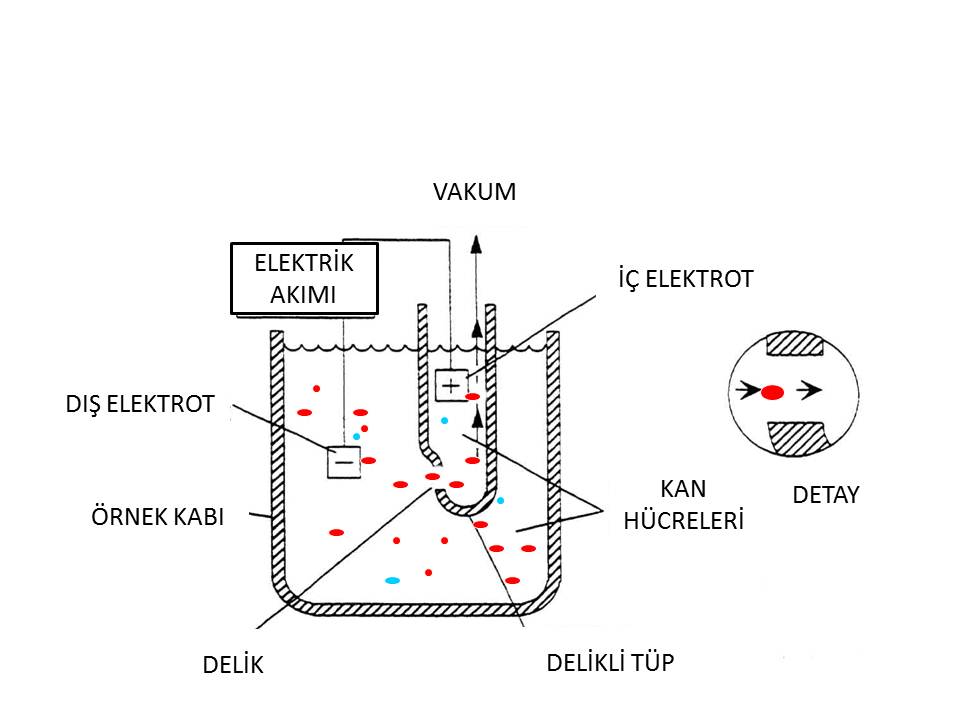
İzotonik bir sıvıda seyreltilmiş kan hücreleri kabın içine daldırılmış ikinci bölüme bir delikten vakumla çekilmektedir. Hücreler delikten geçişleri sırasında yalıtkan olduklarından iki tarafta bulunan elektrodlar arasında voltaj değişiklikleri meydana gelir. Osiloskopla ölçülen voltaj değişiklikleri, hücrelerin büyüklüğü ve sayıları hakkında bilgi verir. Bu bilgiler trombosit ve lökosit histogramlarında gösterilir (Resim 1).
Resim 1) İmpedans yöntemi (Coulter yöntemi) ile kan hücrelerinin sayımı şematik olarak görülmektedir.
İmpedansla lökosit sayımı, eritrositlerin iyonik olmayan deterjanla parçalandığı ayrı bir kanalda yapılır. Lökosit sayımının yapıldığı süspansiyonda fotometreyle HGB de ölçülür. Sayım sonucunda elde edilen verilerden histogram grafikleri oluşturulur.
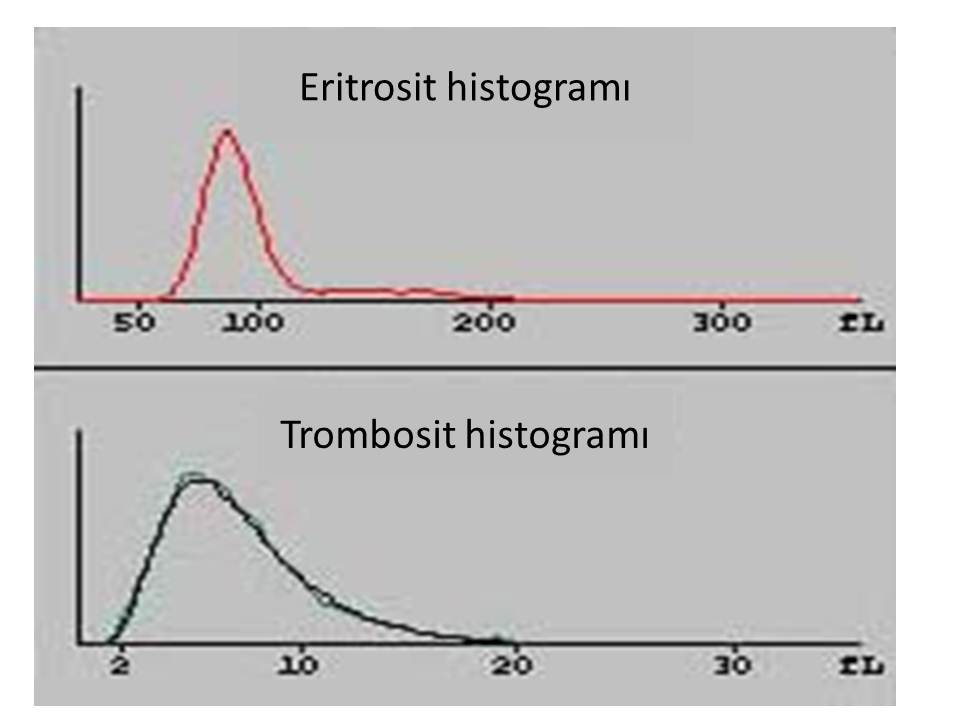
Normal bir kan sayımı histogramında 2-20 fL arasında trombositler bulunmaktadır. Trombosit histogramı pozitif yönde çarpık (log-normal) dağılım göstermektedir. Bazı cihazlarda trombosit histogramına 30 fL büyüklükteki partiküller de dahil edilmiştir. Trombositlerin gösterdiği çarpık dağılımdan yararlanılarak büyüklüğü 70 fL olan trombositleri, küçük eritrositlerden hesapla ayıran cihazlar da vardır.
Eritrosit histogramında alyuvarlar 50-300 fL arasında bulunmaktadır (Resim 2). Normal bir sayımda lökositler ve büyük trombositler eritrositlere göre çok daha az olduğundan histogramda anlamlı bir değişikliğe neden olmamaktadır. Ancak lökosit sayısı 50 bin/uL’yi geçtiği durumlarda kan sayımı sonuçları etkilenmektedir.
Resim 2) Eritrosit ve trombosit histogramları.
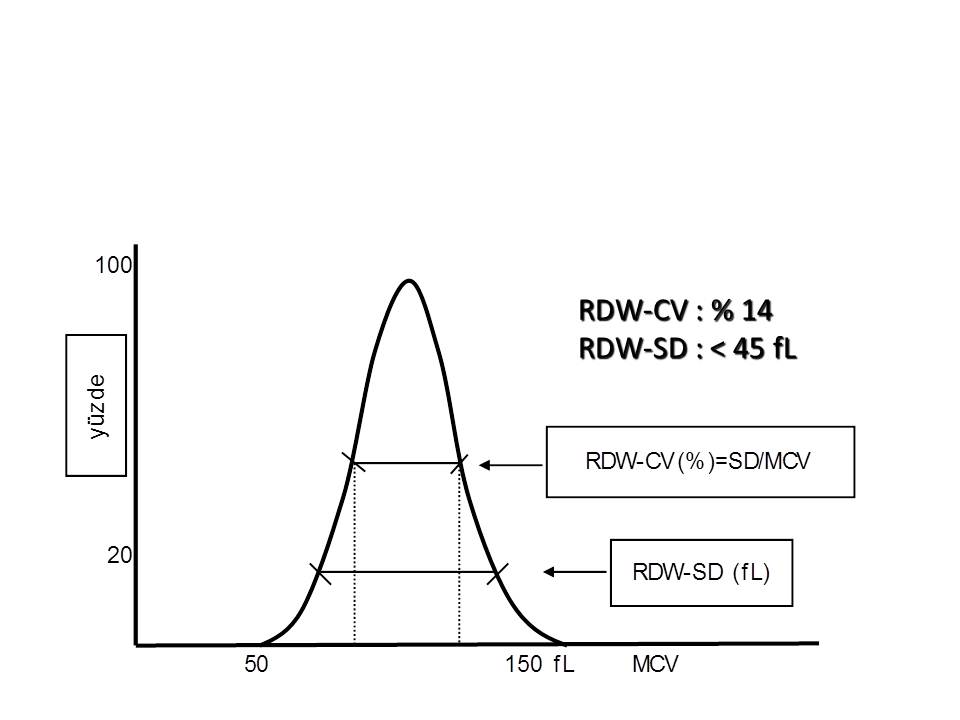
Eritrosit dağılım genişligi (Red cell Distribution Width, RDW) eritrosit histogramından hesaplanmaktadır. RDW eritrosit büyüklüklerinin farkını gösteren bir değerdir. Başka deyişle ÇK yaymasında anizositoz‘un göstergesidir. Klinikte anizositozun tek başına tanı koydurucu bir anlamı yoktur; ÇK’ da eritrosit morfolojisine bakılarak tanı için ipuçları elde edilmelidir. Bundan dolayı, RDW ÇK yaymalarının incelenmesi için bir ölçüt olarak kullanılmaktadır. RDW-SD eritrosit popülasyonundaki makrositik ve mikrositik değişikliklere RDW-CV’ den daha duyarlıdır. RDW-SD Sysmex cihazlarında hesaplanmaktadır (Resim 3).
Resim 3) Eritrosit dağılımı genişliği “Red cell distribution width-coefficient variation” (RDW-CV) ve “Red cell distribution width–standard deviation” (RDW-SD) olmak üzere iki istatiksel hesapla ifade edilmektedir. RDW-CV, 1 SD’deki eritrositlerin histogram genişliğinin MCV‘ye bölünmesi ile bulunur. RDW-SD ise eritrosit histogramında eritrosit popülasyonunun % 20’sinin bulunduğu düzeydeki en büyük ile en küçük eritrosit arasındaki hacim farkıdır. RDW-CV’nin normal değeri % 14’ü, RDW-SD’ninki ise 45 fL’yi aşmaz.
- Radyo dalgaları (radio frequence=RF)
İmpedans yöntemi ile lökosit sayımı yapılırken aynı anda da radyo dalgalarıyla lökositlerin çekirdek büyüklükleri, yoğunlukları ve sitoplazma granülleri hakkında bilgiler elde edilmektedir. Coulter STKS ve MaxM kan sayımı cihazları bu yöntemden de yararlanarak lökosit formülünü yapmaktadır. Bu yönteme, kısaca VCS teknolojisi denmektedir. V volume (=hacim), C conductivity (=iletkenlik), S scatter (=saçılım) kelimelerinin baş harfleridir.
- Optik laser scatter
Ortho Diagnostics kan sayımı için “Optik Laser Scatter” yöntemini 1970 yılında kullanmıştır. Optik laser scatter (optik lazer ışığı saçılımı) yöntemiyle eritrosit, lökosit ve trombositleri saymak mümkündür. Kan sayımı cihazlarında impedans yöntemi ile birlikte kullanılabildiği gibi tek başına da uygulanabilmektedir.
Kan hücreleri bir “akış odası”nda (flow-cell, flow chamber) lazer ışığının önünden geçerken ışığın saçılmasına neden olmaktadır. Lazer ışığıyla kan hücreleri sayılabildiği gibi floresan boyalarla boyanarak, yapıları ayrıntılı olarak incelenebilmektedir. Günümüzde kullanılan gelişmiş, çok kanallı (multichannel) kan sayımı cihazları birden çok yöntemi birlikte kullanarak daha ayrıntılı kan sayımı sonuçlarına ulaşabilmektedir.
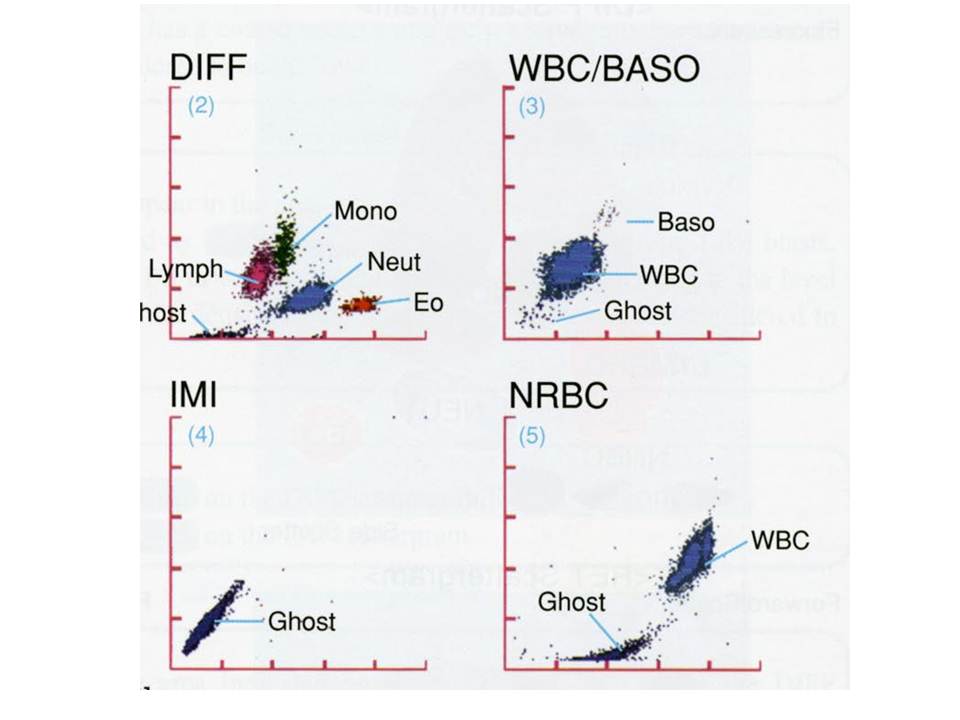
Resim 4) Çok kanallı bir kan sayımı cihazından çıkan lökosit dağılımı grafikleri görülmektedir. DIFF kanalında lenfosit, monosit, nötrofil ve eozinofiller ayrılırken, bazofiller (WBC/BASO), olgunlaşmamış granülositler (IMI) ve çekirdekli eritrositler (NRBC) kanallarında ayrı ayrı sayılarak histogramda gösterilmektedir. Her kanalda sayım için kullanılan ayraçlar farklıdır. Ghost (hayalet) histogramdaki hücre artıklarıdır.
Kan hücrelerinin akış odasında saçtığı lazer ışığı bilgisayar tarafından değerlendirilerek scattergramlar (saçılım grafikleri) çizilmektedir (Resim 5). Lökositlerin sayıldığı kanalda hücreler saçılım grafiklerindeki bulundukları yerlere göre nötrofil, eozinofil, lenfosit ve monosit olarak ayrılmaktadır. Ayrımın yapılamadığı anormal hücrelerin bulunduğu durumlarda “flag (bayrak)” adı verilen uyarıcı bilgiler (Blast, Immature granülosit: olgunlaşmamış granülosit, Atypical Lympho, NRBC: çekirdekli eritrosit, Left shift: sola kayma gibi…) verilmektedir.
Otomatik Kan Sayımı Cihazlarıyla Trombosit sayımı
Birçok kan sayımı cihazında trombositler impedans yöntemi ile sayılmaktadır. İmpedans ile trombositlerin sayımındaki zorlukların başında küçük olmaları, kısa sürede kümeleşmeleri (agregasyon) ve EDTA’lı ortamda gelişebilen psödotrombositopeni gelir. Bunların yanında parçalanmış eritrositler, şistositler ve lökosit parçacıkları büyüklükleri yönünden trombositler ile karışabilir.
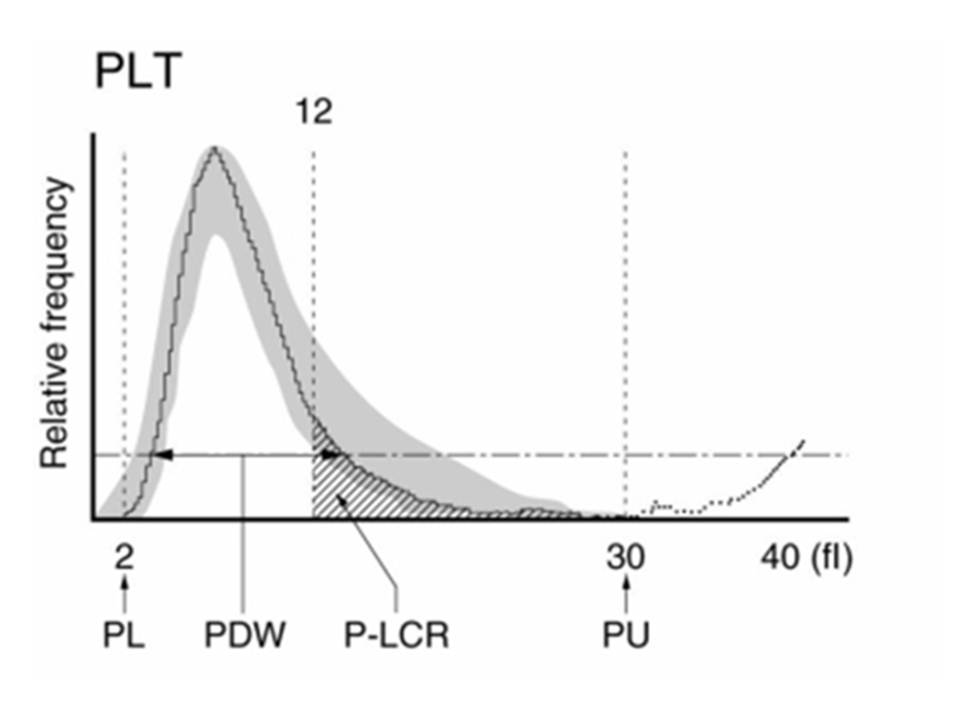
Resim 5) Trombosit sayımının histogramı. Gri bölgeli alan normal değerleri göstermektedir. Trombosit histogramının alt limiti (PL) 2 fL, üst limit (PU) ise 30 fL’dir. Büyük trombositler 12 fL ile 30 fL arasında yer alır, (histogramdaki taralı alan). Büyük trombositlerin normal olanlara oranına P-LCR (Platalet-Large Cell Ratio) denmektedir.
Trombosit histogramı sola çarpık dağılım (log normal dağılım) göstermektedir. Trombosit indeksleri, PDW (Platelet Distribution Witdh =trombosit dağılımı genişliği) ve P-LCR, trombosit histogramından hesaplanır. Genç trombositler büyük olurken yaşlı trombositler daha küçük olmaktadır. ITP ve aşırı trombosit tüketiminde yapım arttığından trombositlerin hacimleri de artmaktadır.
Optik yöntemle trombosit sayımı floresan boyalar kullanılarak yapılmaktadır. Sysmex (XE-2100) kan sayımı cihazları RNA/DNA’yı floresan polimethin boyası ile retikülosit kanalında saymaktadır. Özellikle trombosit sayısının düşük (< 50 bin/µL) ve parçalanmış eritrosit sayısının yüksek olduğu durumlarda optik yöntemle sayımın değeri artar.
İmmünolojik sayım, trombositlerin yüzeyinde bulunan antijenlerin (CD41, CD61) floresan işaretli monoklonal antikorlarla boyanarak, akar hücre ölçümü (flow cytometry)yöntemi ile sayılmasıdır. Özellikle, düşük trombosit sayılarında immunolojik yöntem en güvenilir olandır. İmpedansla trombosit sayısı 30 bin/µL altında trombosit transfüzyonü gerekirken, immünolojik yöntemle bu sayı 10 bin/µL’dir. Bazı kan sayımı cihazları immünolojik yöntemle trombosit sayımı yapabilmektedir.
Eritrosit indekslerine benzer şekilde ortalama trombosit hacmi (Mean Platalet Volume: MPV), trombosit dağılımı genişliği (Platelet Distribution Width, PDW) ve büyük trombosit oranı (Platalet Large Cell Ratio, P-LCR) gibi çeşitli trombosit indeksleri de hesaplanmaktadır . EDTA’lı kanda trombositlerin büyüklükleri kolayca değiştiğinden trombosit indekslerinin pek anlamı yoktur; standardize edilmediğinden de rutin olarak kullanılmamaktadır.
KAN SAYIMI CİHAZLARIYLA LÖKOSİT FORMÜLÜ
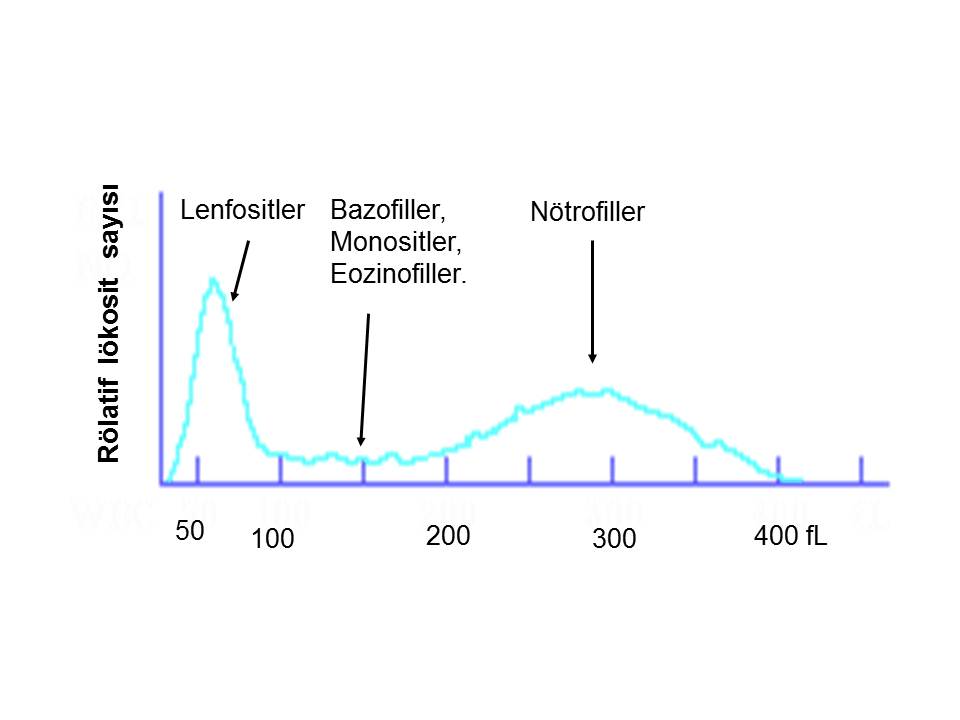
İmpedans ile “üçlü lökosit formülü ”yönteminde lökositler lenfosit, nötrofil ve orta büyüklükteki lökositler olmak üzere üç gruba ayrılmıştır. Kanın özel bir deterjanla sulandırıldığı süspansiyonda lökositlerin büyüklüklerinin impedansla ölçülmesi ilkesine dayanır. Veriler lökosit histogramında gösterilir. Lenfosit ve nötrofillerin değerlendirilmesinde bu cihazlar faydalı olmaktadır (Resim 6).
Resim 6) Üçlü lökosit formülü, impedansla ölçüm yapan kan sayımı cihazlarında bu özellik vardır.
Akar hücre ölçümü yöntemi ve radyo dalgalarıyla ölçümün gelişmesiyle kan sayımı cihazları beşli lökosit formülü (nötrofil, eozinofil, bazofil, monosit ve lenfosit) yapabilir duruma gelmiştir. Bugün kullandığımız geliştirilmiş cihazlar eritroblast (NRBC) ve genç granülosit (olgun olmayan=immature granülosit, IG) sayımı da yapabilmektedir.
RETİKÜLOSİT SAYIMI
Eritrositler, çekirdeklerini kaybettikten sonra bir süre daha bünyelerinde RNA bulundurmaktadır. Retikülosit sayısı kemik iliğinin hematopoetik aktivitesi hakkında bilgi verir. Normal olarak ÇK da dolaşan eritrositlerin kabaca % 1’i (% 0.5-2.0) retikülosit evresindedir . Ancak retikülosit yüzdesi eritrosit sayısının azaldığı durumlarda yanıltıcı olabileceğinden “mutlak retikülosit sayısı” ve “düzeltilmiş retikülosit sayısı” hesaplanmalıdır (bkz. Retikülosit sayımı).
Düzeltilmiş retikülosit yüzdesi = Hastanın retikülosit yüzdesi x Hasta HCT ÷ 45
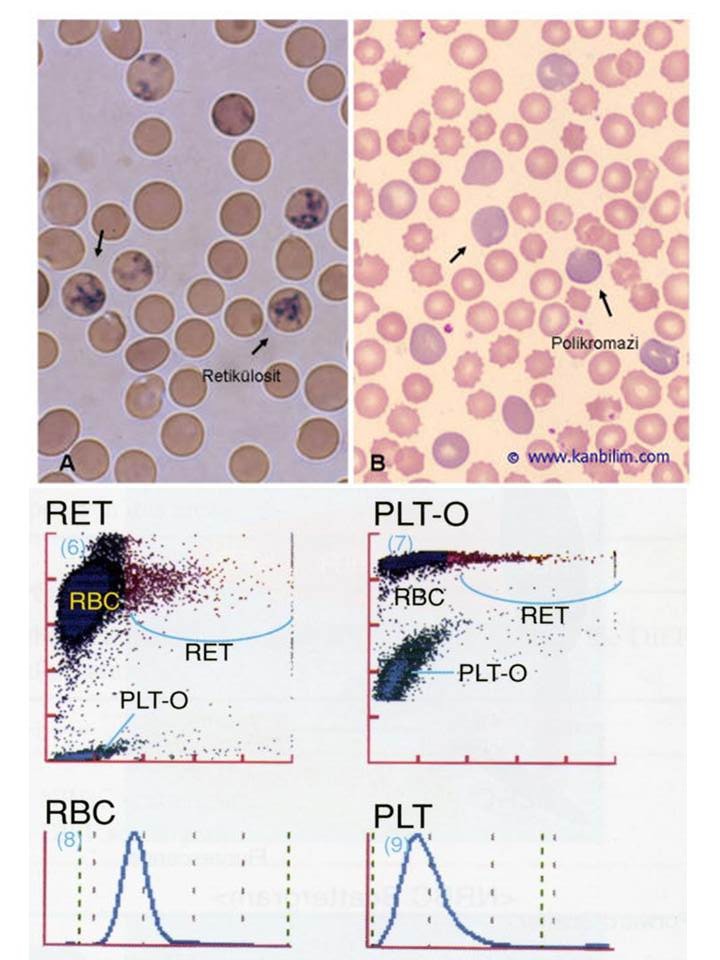
Otomatik retikülosit sayımı 1990 yılında gerçekleşmiş ve kan sayımı cihazları genç retikülositlerin “Immature Reticulocyte Fraction, (IRF)” sayımına da olanak sağlamıştır. Genç retikülositlerde yaşlılara göre daha çok RNA bulunmaktadır. Artışı kemik iliğinin eritrosit yapımına başladığının ilk göstergesidir. IRF, eritropoetin tedavisinde ve kemik iliği naklinde takip parametresi olarak kullanılmaktadır. Retikülosit sayımında kullanılan floresan boya aynı zamanda trombositleri de boyadığından bu kanalda optik olarak trombosit sayısını da belirlemek mümkündür (Resim 7).
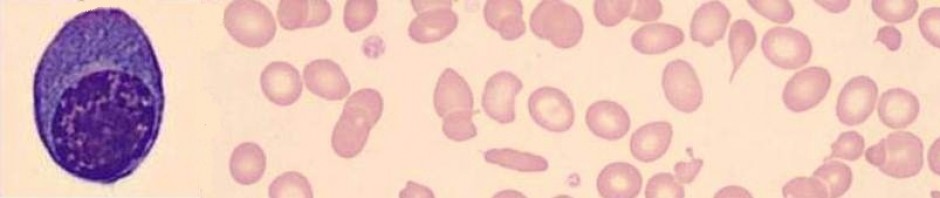
Resim 7) Retikülosit sayımı ve polikromazi: Retikülositler normal eritrositten biraz daha büyüktür. İlikten dolaşıma çıktıktan sonra 1 gün içinde olgun eritrosit haline dönüşür. A) Sitoplazmadaki ağ şeklindeki RNA kalıntıları krezil mavisi, metilen mavisi gibi boyalarla yapılan supravital boyamada görünür hale gelir (manuel retikülosit sayımı). B) MGG ile boyanmış yaymalarda normal eritrositlerden biraz daha büyük olan retikülositler mavi-pembe-grimsi renkte boyanırlar (polikromazi). Yukardaki her iki yayma retikülosit sayısı yüksek (retikülositozlu) hastalardan hazırlanmıştır. Resimlerin altındaki grafikte retikülosit sayımı (RET) ile birlikte optik trombosit sayımı (PLT-O) yapan cihazın çıktıları görülmektedir.
RET-He, retikülositlerin HGB’ inini gösteren bir parametredir. Kemik iliğinin gerçek zamanlı demir durumunu gösterir. Demir tedavisine başlandıktan 3-4 gün sonra RET-He artış gösterir. RET-He ve “reticulocyte hemoglobin content (CHr)” iki farklı cihazın ölçtüğü ve birbirinin eşdeğeri parametrelerdir.
IRF ve RET-He dışında da retikülosit indeksleri ölçülmekte ve hesaplanmaktadır. Ancak bunların ölçümü kullanılan kan sayımı cihazına bağımlıdır, tam olarak standardize edilmemiştir ve referans değerleri de tam olarak oluşturulmamıştır.