Otomatik kan sayımları her zaman doğru olmayabilir. Laboratuvarlar sayım hatalarını bularak gerekli düzeltmeleri yapmak zorundadır. Hatalı sayımlar yetersiz kan örneğinden, antikoagülanların yol açtığı sorunlardan, hastalara ait özel patolojik nedenlerden veya kan sayımı cihazlarının teknik özelliklerinden ortaya çıkabilir.
Sonuçların doğruluğundan emin olabilmek için öncelikle kan sayımı cihazlarının günlük kalite kontrolleri yapılmış olmalıdır. Hastaya ait daha önceki sayımlarla yeni sonuçlar karşılaştırılır (Delta kontrol). Delta kontrol preanalitik hataların bulunmasında yararlıdır. Bir hastanın MCV ve MCHC değerleri birkaç gün içinde değişmez. Lökosit, trombosit ve eritrosit değerlerindeki büyük değişikliklerin de bir klinik açıklaması olmalıdır.
Bu kontrollerden sonra normal olmayan sayımların histogram ve lökosit dağılım grafikleri incelenir. Örneğin alındığı gün, saat ve miktarı kontrol edilir. Kanda pıhtı, hiperlipidemi ve hemoliz olmamalıdır.
Kanın alınmasında ve laboratuvara gönderilmesinde bir sorun yoksa, cihazın verdiği uyarılara (ing flag: bayrak) ve laboratuvarın ÇK yayma kurallarına göre manuel yöntemlerle kontrol yapılır. Bulunan hatalar giderildikten sonra sonuçlar bildirilir. Değerlendirme sırasında hastanın klinik tanısının ve uygulanan tedavinin bilinmesi de çok önemlidir.
Basit olarak aşağıdaki tabloda laboratuvarımızda uyguladığımız ÇK yaymasını inceleme kuralları belirtilmiştir. International Society for Laboratory Hematology (ISLH) kan sayımı sonuçları kontrol edilirken yapılması gerekenleri ve ne zaman yapılacağını çok ayrıntılı biçimde açıklamıştır (www.islh.org). Her laboratuvarın kullandığı kan sayımı cihazına ve ihtiyaçlarına göre kendi ÇK yayması inceleme kuralları olmalıdır.
| Parametre | Kriter | Yapılması gereken |
| MCV | < 75 fL veya >105fL | Çevre kanı yayması |
| Trombosit sayısı | < 100 bin/µL veya >1000 bin/µL | Çevre kanı yayması |
| Lökosit sayısı | <4 bin/µL veya >30 bin/µL | Çevre kanı yayması |
| RDW-CV | >22 % | Çevre kanı yayması |
| MCHC | <30 % veya >38 % | Çevre kanı yayması |
| Lökosit formülü | Cihazın verdiği tüm uyarılarda | Çevre kanı yayması |
Kan Sayımını Etkileyen Durumlar
Otomatik kan sayımı cihazları ne kadar doğru kalibre ve kontrol edilmiş olsalar da bazen hastanın kan örneğindeki özelliklerden etkilenerek yanlış ölçüm yapabilmektedir. En sık rastlanan ölçüm hatalarına neden olan durumlar ve sayım örnekleri aşağıda belirtilmiştir:
- Soğuk aglütininler ve kriyoglobulinemi
Soğuk aglütininler oda ısında eritrositlerin kümeleşmesine neden olduğundan eritrosit sayısı kan sayımı sırasında olduğundan daha düşük bulunur. Kümeleşen eritrositler MCV’nin yüksek ölçülmesine neden olur. Hesapla bulunan eritrosit indeksleri, özellikle MCHC yanlıştır.
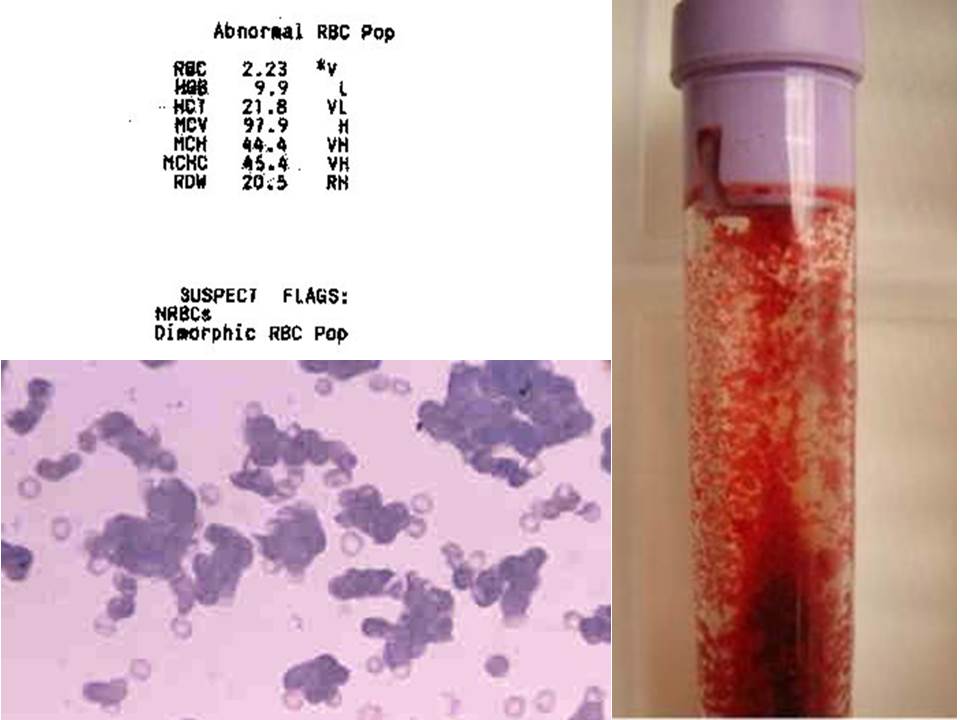
Resim 1). Kanında yüksek titrede soğuk aglütinin bulunan bir hastanın kan sayımı sonucu çıktısı. Kan tübünde makroskopik olarak eritrositlerin kümeleştiği görülüyor. ÇK yaymasında da eritrositler kümeler oluşturmuş (otoaglütinasyon). Kan sayımı sonucunda MCHC % 45,4 olarak bulunmuştur. Kan ısıtılarak sayıldığında sonuçlar düzelerek HGB 7,7 g /dL, HTC %23,8 ve MCHC de % 32,5 olarak saptanmıştır. Soğuk aglütininlerden kaynaklanan sayım hatalarını önlemek için kan örneği 37○C’de ısıtılmış enjektörle alınmalı ve bekletilmeden 37○C’de benmariye konmalı ya da oda ısısında bekletilmişse ısıtılarak sayılmalıdır (bkz Soğuk Aglütinin Hastalığı).
Eritrositlerle 37○C’ den düşük ısılarda birleşen soğuk aglütininleri (eritrosit antikorlarını), düşük ısılarda çöken (presipite olan) kriyoglobulin adı verilen İg’lerle karıştırmamak gerekir. Soğukta reaksiyona girme dışında hiçbir benzerlikleri yoktur. Neden oldukları klinik tabloların adı birinde soğuk aglütinin hastalığı, diğerinde kriyoglobulinemi‘ dir. Kriyoglobulinler de otomatik kan sayımı sonuçlarını etkileyerek lökosit ve trombosit sayılarının yüksek çıkmasına neden olurlar (bkz Kriyoglobulinemi).
- Lipemi ve ikter
Lipemik ve ikterik kanları santrifüjde çevirdikten sonra gözle kolaylıkla ayırmak mümkündür. Kan sayımında bulanıklıktan dolayı HGB yüksektir. Lipid partikülleri lökosit veya trombositlerle karışabilir. MCV olduğundan daha yüksek bulunur. Kan sayımının yanlış olduğu MCHC’nin normal bulunmamasından anlaşılır. Sayım yapılabilmesi için kan santrifüj edilerek hücrelerin üzerindeki plazma alınır ve yerine aynı hacimde kan sayımı cihazının sulandırma çözeltisi eklenir. Kan iyice karıştırıldıktan sonra sayım yapılır. Trombosit ve lökosit sayısı ÇK yayması hazırlanarak da kontrol edilebilir.
- Hemoliz
Hemoliz eritrositlerin herhangi bir sebepten parçalanarak içlerinde bulunan HGB’nin plazmaya geçmesidir. Parçalanan eritrositler kan sayımı cihazında sayılmadığından olduğundan daha düşük sayıda bulunur. Dolayısıyla HCT de olduğundan daha düşüktür. MCHC ise normalden daha yüksektir. Kan sayımı tübü santrifüj edilerek plazmadaki hemoliz miktarı görülebilir. Kanın alımı sırasında hemoliz olması HGB miktarının yanlış ölçülmesine neden olmaz. Aşırı hemolizli örnekler diğer eritrosit parametreleri için tekrar alınarak sayılmalıdır.
- Anormal hemoglobinler
Litik ajanlara dirençli eritrositler (hemoglobin S, C, F, üremi ve yenidoğan eritrositleri) optik saçılım ile sayım yapan cihazlarda problem olmaktadır. Lökosit sayısı ve hemoglobin miktarı yüksek bulunur.
- Mikrosit ve şistositler
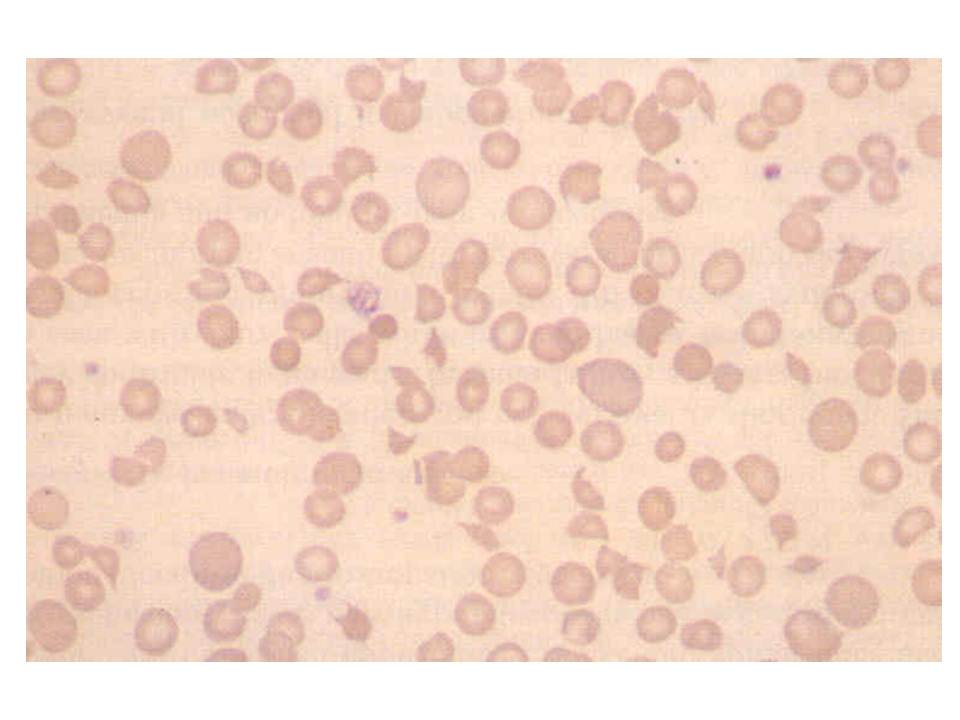
Küçük eritrositler (<50 fL) eritrosit histogramında yer almazlar, trombosit histogramına girebilirler. Bu durumda eritrosit sayısı düşüktür, daha önemlisi trombosit sayısı olduğundan daha yüksek bulunur (Resim 2). ÇK yaymalarında fragmantasyon görülmesi hastanın sağlığı (prognozu) açısından çok önemlidir (Resim 3).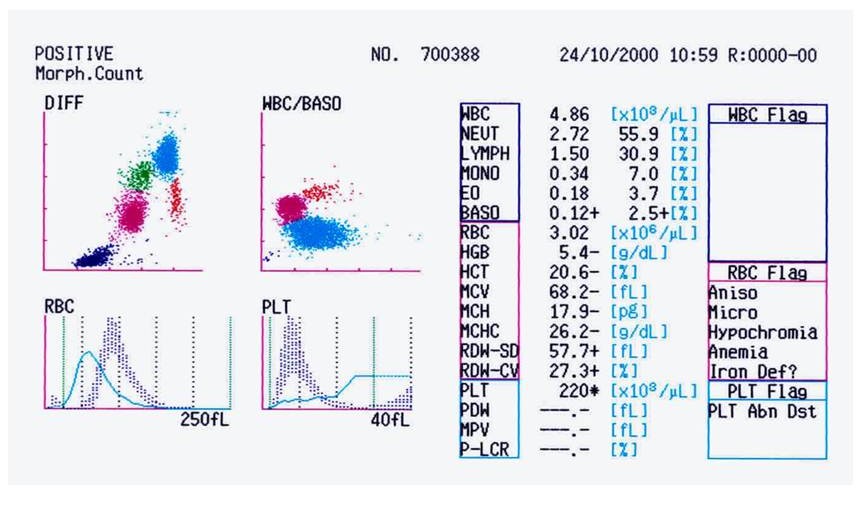
Resim 2) Ağır demir eksikliği anemisi (HGB 5,4 g/dL) olan hastaya ait kan sayımı cihazından alınan çıktı. Lökosit formülü grafiğinde dağılım normal görülmektedir. Eritrosit uyarıları ağır demir eksikliği olabileceğini göstermektedir. Çok küçük eritrositler histogramda trombositlerle karışmış. Ağır demir eksikliği anemisinde MCHC hafif düşük olabilir (26.2 g/dL). Eritrosit ve trombosit histogramı incelendiğinde (mavi çizgi hastanın histogramını, gri taralı alan normal dağılımı göstermektedir) küçük eritrositler ve trombositler köprü yapmaktadır. Anormal trombosit dağılımı (PLT Abn Dst) uyarısı sonucu hazırlanan ÇK yaymasında hastanın, cihazın verdiği sonucun aksine, trombositopenik olduğu görülmüştür.
Resim 3) ÇK yaymasında parçalanmış (fragmante) eritrositler görülmektedir. Mikrositik eritrositler, şistositler ve parçalanmış eritrositler sayıları fazla olduğunda impedansla sayımda trombositlerle karışır. Yalancı olarak eritrosit sayısı düşerken, trombosit sayısında artış görülür. Trombotik trombositopenik purpura (TTP) ve hemolitik üremik sendrom (HUS) ÇK’da eritrosit parçalanması, trombositopeni ve hemoliz bulguları ile seyreden ölümcül hastalıklardır. Laboratuvarın erken tanısı hayat kurtaracaktır.
- Olgun eritroblastlar ve megakaryosit parçaları
Ortokromatofil eritroblastlar ve megakaryosit çekirdeği parçaları impedansla lökosit sayımı sırasında lökosit olarak algılanarak lökosit sayısının yüksek bulunmasına (yalancı lökositoz) neden olabilir. Bu durumda mikroskopta lökosit formülü yapılarak 100 lökosite örn kaç eritroblast düştüğü saptanarak gerçek lökosit sayısı hesaplanmalıdır.
- Trombosit kümeleri
EDTA’lı kan örneklerinde normalde trombositler küme oluşturmazlar. Bazı hastaların (% 0.1) trombositleri EDTA’lı ortamda doğal trombosit antikorlarına bağlı olarak kümeleşebilir. İmpedans yöntemi ile sayımda bu kümeler trombosit olarak sayılamadığından trombosit sayısı düşük çıkar.
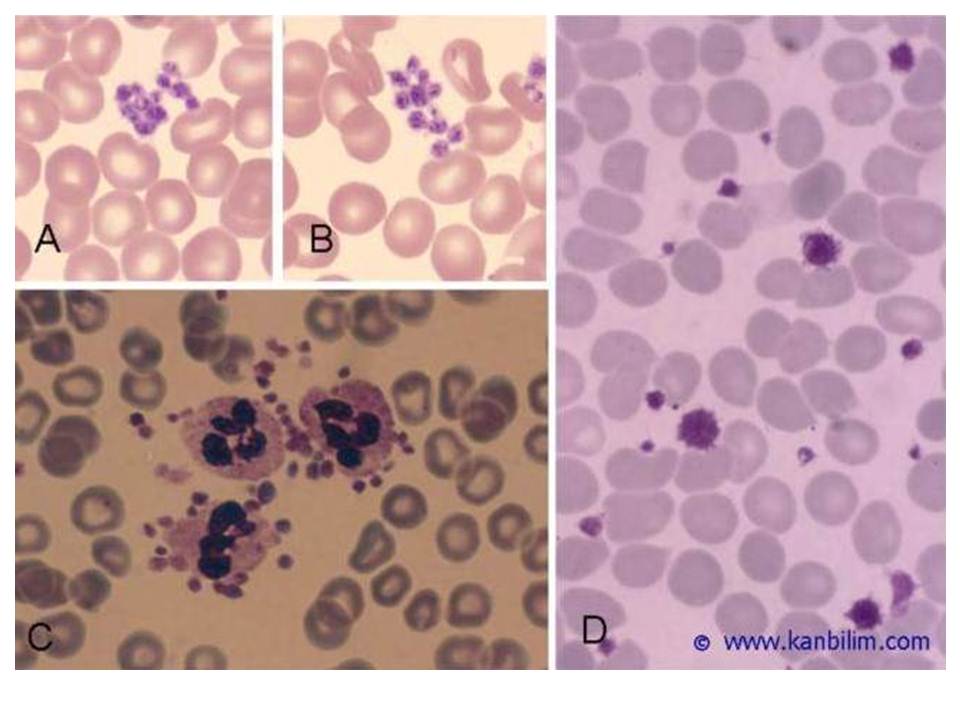
Resim 4) A ve B) ÇK yaymalarında trombosit kümeleri. Preparat parmaktan alınan kapiller kandan hazırlanmıştır. Antikoagülansız kan örneklerinden bekletilmeden hazırlanan yaymalarda trombositler tek tek durmaz ve irili ufaklı kümeler yapar. Trombositlerin agregasyon işlevlerinin bozulduğu Glanzmann hastalığında trombositler kümeleşemez. Normal kişilerde %0.1 sıklığında karşılaşılan doğal antikorlar EDTA’lı ortamda trombositleri kümeleştirir. Trombositleri impedans yöntemiyle sayan cihazlar bu kümeleri, büyüklükleri nedeniyle, trombosit olarak algılayamaz (psödotrombositopeni), lökosit olarak sayar, C) Nötrofil parçalı lökositlerin çevrelerine yapışmış trombositler (trombosit satellitizmi) bir diğer yalancı trombositopeni nedenidir. D) Makrotrombositler, Dev trombositler. Normalden çok büyük trombositler miyeloproliferatif hastalıklarda (özellikle esansiyel trombositemi) ve nadir herediter trombosit işlev bozukluklarında (Bernard-Soulier sendromu, May-Hegglin anomalisi, vd) görülür. Yukardaki yayma esansiyel trombositemili bir hastadan hazırlanmıştır.
- Lökosit sayısı > 50 bin/µL
Lökosit sayısı > 50 bin/µL ise MCV ve HTC olduğundan daha büyük bulunur. Kan sayımı sonucunda MCHC’nin normalden düşük olduğu görülür. Lökosit sayısının fazla olması HGB ölçümünde bulanıklıktan dolayı artışa neden olabilir. Bu durumda manuel HGB ölçümü yapılabilir. Bulanıklığı önlemek için lökositler santrifüj ile çöktürülür, sonra fotometrede okuma işlemi yapılır (Resim 5).
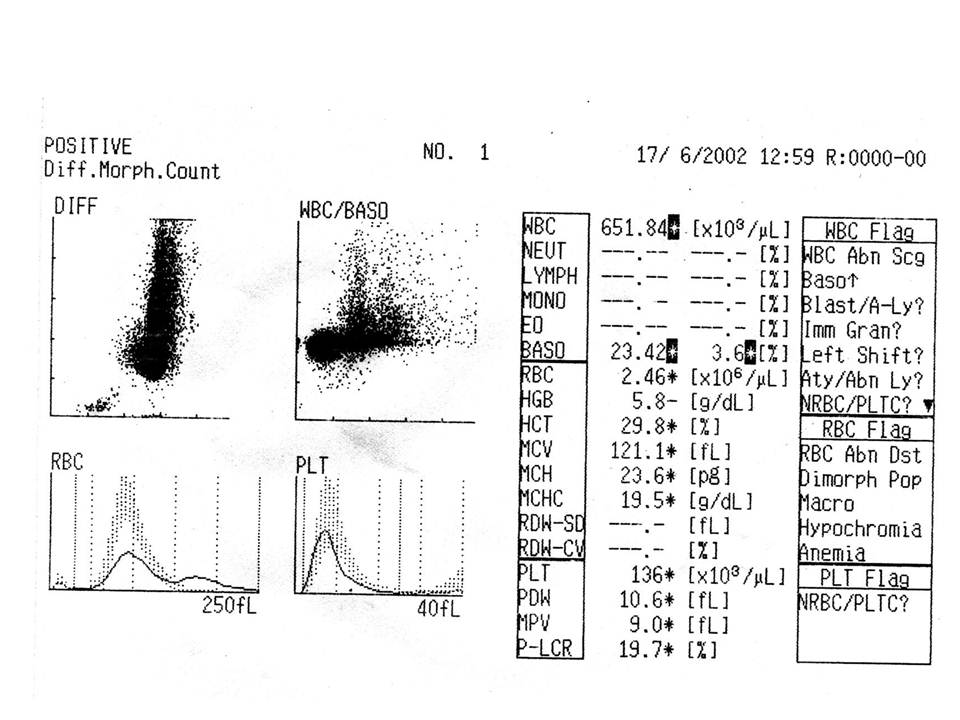
Resim 5) Lökosit sayısı çok yüksek olan KLL’ li bir hasta. Lökosit sayısı bazı cihazların sayamayacağı kadar yüksek, eritrosit histogramında 250 fL civarında ikinci bir pik oluşmuş. Dolayısıyla yanlış olarak MCV 121,1 fL olarak görülüyor. Bundan HTC de etkilenmiş, MCHC ‘nin 19,5 g/dL olması da sayım sonucunun yanlış olduğunun göstergesi. Manuel HTC ve HGB ölçümü yapılmalıdır. ÇK yayması hazırlanarak lökosit formülü incelenmeli ve trombosit sayısı kontrol edilmelidir. Lösemi tedavisi sırasında ve bazı kan hastalıklarında lökositler parçalanarak trombosit sayısının yüksek bulunmasına neden olabilir. Bu durumda gerçek trombosit sayısı için optik trombosit sayımı veya monoklonal antikorlarla (CD41, CD61) immünolojik trombosit sayımı gerekir.
- Bekletilmiş kan.
İdael olarak EDTA’lı kan örnekleri üç saat içinde sayılmalıdır. Kan bekletildikçe eritrositler şişebilir (MCV artar), trombositler bozulur ve sayıları düşer. Lökositler EDTA içinde çabuk bozulur. Çevre kanı yaymaları bir saat içinde hazırlanmalıdır.
ÖZET
Sağlık Bakanlığının yayımladığı Hastane Hizmet Kalite Standartları gereği laboratuvarlar bir “dış kalite kontrolü” programını takip etmelidir. Bu şekilde sayım sonuçlarının diğer laboratuvarlarla uyum içinde olduğu sertifika ile belgelenir.
Günlük çalışmadan önce “iç kalite kontrolü” ile kan sayımı cihazının doğru çalıştığı gösterilmelidir. Bu kontrol kanları kan sayımı cihazını üreten firma tarafından temin edilmektedir. İç kalite kontrollerinin sonuçları dosyasında saklanmalıdır. Bazı kan sayımı cihazlarının bilgisayarında kalite kontrol dosyaları bulunmaktadır. Kalite belgesi almak isteyen laboratuvar denetimleri sırasında iç kalite kontrollerinin sonuçlarını veya grafikleri gösterebilmelidir.
Kan sayımı cihazının periyodik bakımları düzgün olarak yapılmalı, servis tarafından giderilen arızaların kayıtlı olduğu raporlar da dosyalanmalıdır.
Kan sayımı sonuçları önce laboratuvar teknisyenleri tarafından değerlendirilmelidir. Hastanın eski sonuçları preanalitik hataları önlemek için yeni sayımla karşılaştırılarak kontrol edilmelidir (Delta kontrol). Uyarı mesajı taşıyan veya laboratuvarlarda oluşturulmuş “Çevre Kanı Yayması İnceleme Kuralları” çerçevesinde inceleme gerektiren kan sayımı sonuçları, kontrollerden sonra bildirilmelidir.
Her laboratuvarın oluşturduğu “panik değerlere” göre hastanın hekimine gecikmeden sonuçlar bildirilmeli ve bunların kayıtları tutulmalıdır.
Amaç kan sayımlarını doğru yapmak, laboratuvarlar arasındaki farklılığı kaldırmak, sayım sırasında meydana gelebilecek hataları laboratuvarda bularak çözmek, hastanın sağlığını etkileyecek kritik sonuçları en kısa sürede hekimlerine ulaştırmak olmalıdır. Bu doğrultuda her laboratuvar kendince oluşturduğu uyulması gereken yol ve yöntemleri izlemelidir.
KAYNAKLAR
- Bain B J: Performing a blood count. In Bain BJ: Blood Cells, A practical Guide, Blackwell Publishing, 2006
- Coulter Electronics: Coulter Maxm Operator’s Guide (PN 423745-B) . Miami, FL Coulter Corporation: 1996
- Hastane Hizmet Kalite Standartları, T.C. Sağlık Bakanlığı, Performans Yönetimi Kalite Geliştirme Daire Başkanlığı, Ankara 2011
- Miers MK, Exton MG, Daniele C: Cell-Counting and Coagulation Instrumentation. In Bernadette F R (ed): Diagnostic Hematology, Philedelphia WB Saunders, 1995:599-631.
- Sysmex corparation: Operator’s Manual SF-3000: 1999
- Sysmex: Proceedings of the Sysmex European Haematology Symposium, May 14-15, 2009, İstanbul.
- Sysmex: Proceedings of the Sysmex European Haematology Symposium, 2003.
- www.uptodate.com, George TI, Automated hematology instrumentation, 2012
- www.uptodate.com, Shrier SE, Mean Corpuscular Volume, 2012
- Ryan D H: Examination of Blood Cells. In Williams Hematology, Mc Graw Hill, Eighth edition, 2010
- www.islh.org
- Perkins S L; Principle of Hematologic examination. In Wintrobe’s Clinical Hematology, 10th edition.
- Zandecki M, Genevieve F, Gerard J, Godon A : Spurious counts and spurious results on haematology analysers: a review. Part I: platelets, Int. Jnl. Lab. Hem. 2007, 29, 4–20
- Zandecki M, Genevieve F, Gerard J, Godon A : Spurious counts and spurious results on haematology analysers: a review. Part II: white blood cells, red blood cells, haemoglobin, red cell indices and reticulocytes. Int. Jnl. Lab. Hem. 2007, 29, 21–41
- Kottke-Marchant K, Davis B H : Laboratory Hematology Practice, Wiley-Blackwell, 2012.